目的 评估高分辨率显微内镜(high-resolution microendoscopy,HRME)对胃癌病理分型的诊断价值。方法 选择普外科胃癌手术切除的大体标本10例,利用HRME进行成像,总结图像特点,制定胃癌及不同病理分型胃癌的HRME诊断标准。根据建立的诊断标准,对消化内镜中心行胃镜检查发现可疑胃癌的40例活检标本进行成像并作预诊断,将预诊断结果与病理结果比较,评估HRME对胃癌分型诊断的价值。结果 HRME诊断为胃癌共32例,经病理证实为癌的共29例。经统计学分析,HRME诊断胃癌的敏感性为96.7%,特异性为70.0%,准确性为90.0%,阳性预测值为90.6%,阴性预测值分别为87.5%,一致性检验Kappa值为0.71。HRME诊断为分化型胃癌共15例,经病理证实的有12例;HRME诊断为未分化型胃癌共14例,经病理证实的有12例。经统计学分析,HRME对胃癌分型诊断的敏感性为80.0%,特异性为85.7%,准确性为82.8%,阳性预测值为85.7%,阴性预测值为80.0%。结论 根据HRME图像能够将胃癌分为分化型和未分化型,具有较高的诊断价值。
Objective To evaluate the diagnostic value of high-resolution microendoscopy in pathological typing of gastric cancer.Methods 40 biopsy specimens suspected of gastric cancer sampled from patients undergoing gastroscopy examination in the General Hospital of Chinese People’s Armed Police Force and 10 cases of surgical resected gastric cancer specimens from the Department of General Surgery were enrolled in this study. 10 cases of surgical resection specimen of gastric cancer were used for HRME imaging to summarize the characteristics of the HRME images and make the HRME diagnostic criteria of gastric cancer and its pathological type. Based on the criteria, the endoscopic biopsy specimens suspected of gastric cancer were used for HRME imaging to make a prior diagnosis, and compared the results with pathological results to assess the diagnostic value of HRME for gastric cancer.Results 32 patients were diagnosed as cases of gastric cancer by HRME in whom 29 cases were confirmed by histopathology. By statistical analysis, the sensitivity, specificity, accuracy, positive predictive value and negative predictive value were 96.7%, 70.0%, 90.0%, 90.6%, and 87.5%, respectively. In consistency analysis, k value was 0.71. Fifteen patients were diagnosed as cases of differentiated gastric cancer in whom 12 patients were confirmed by histopathology. 14 patients were diagnosed as cases of undifferentiated gastric cancer in whom 12 patients were confirmed by histopathology. On statistical analysis, the diagnostic value showed that the sensitivity, specificity, accuracy, positive predictive value and negative predictive value were 80.0%, 85.7%, 82.8%, 85.7%, and 80.0%, respectively.Conclusions According to the high-resolution microendoscopy images, gastric cancer can be divided into differentiated and undifferentiated type with high diagnostic value.
胃癌是世界范围内死亡率第二位的恶性肿瘤[1]。胃癌患者的预后与其组织病理分型有关。内镜检查及活检组织病理学检查是目前确定胃癌分型的金标准。然而, 活检病理制片过程复杂、费时, 并给患者带来出血、感染等风险[2]。因此, 亟需一种能够实现实时显微组织观察的内镜技术, 使内镜检查的同时做出胃癌的分型诊断, 从而为胃癌的治疗决策提供帮助。高分辨率显微内镜(high-resolution microendoscopy, HRME)以其实时组织病理成像、图像清晰、经济实用等优势, 展现了良好的应用前景并迅速成为研究热点。本实验利用自主研发的HRME设备开展了一些前期研究, 发现HRME能够清晰地分辨正常胃黏膜和胃癌组织。本研究的目的是建立不同分型胃癌的HRME诊断标准, 并进一步探索其对胃癌分型的诊断价值。
选择2015-02至2016-02于我院消化内镜中心行胃镜检查发现可疑胃癌的活检标本50例, 其中男31例, 女19例, 平均(55.0± 7.9)岁。
1.2.1 HRME成像设备 HRME的主要组成部件包括一根光纤(30 000像元, 长1.8 m, 直径1 mm)、二向色镜(500 nm)、物镜(10× )、激发光及发射光滤光片、准直镜片、LED光源、CCD相机。该成像系统系自主研发, 见图1。LED光源发出波峰为455 nm的激发光, 经滤光片过滤形成窄谱断的光, 经物镜聚焦后沿光纤传至被观测组织的表面。组织表面产生的荧光信号经原光纤返回, 经物镜放大后传导至CCD芯片上进行成像, 从而得到被观测组织的即时组织病理成像。该成像系统的视野为720 μ m, 空间分辨率为4.4 μ m, 摄像速度为17帧/s。
1.2.2 试剂与药品 0.05%吖啶黄盐酸盐(美国Sigma公司)、生理盐水(辰欣药业股份有限公司)、链酶蛋白酶颗粒(北京泰德制药股份有限公司)、碳酸氢钠(北京泰德制药股份有限公司)。
1.2.3 HRME成像过程 将标本用生理盐水冲洗去除表面残留的杂质, 再用链蛋白酶溶液冲洗去除黏液, 最后再用生理盐水冲洗。冲洗完毕的标本置于工作台, 保持黏膜面在上, 展开标本, 表面喷洒0.05%吖啶黄2~3 ml, 30 s后进行成像。
1.2.4 病理组织学检查 成像结束后, 大体标本根据成像位点进行点对点活检。所有活检标本经甲醛固定、HE染色后由2名病理医师进行诊断。
1.2.5 HRME图像筛选 按以下标准进行图像筛选:(1)质量好, 图像没有运动伪影, 组织细胞结构清晰可辨; (2)质量中等, 有运动伪影, 组织细胞结构可识别; (3)质量差, 有运动伪影, 组织细胞结构难以识别。将质量差的HRME图像剔除。
1.2.6 建立HRME诊断标准 选择普外科胃癌手术切除的大体标本10例。根据病理诊断结果, 由2名高年资内镜医师对胃癌大体标本的HRME图像进行分析, 总结图像特征, 如胃小凹的形态, 腺体的结构, 细胞核的大小、排列方式等, 制定胃癌及不同分型胃癌的HRME诊断标准。
1.2.7 评估HRME诊断价值 根据1.2.6建立的不同分型胃癌的HRME诊断标准, 对40例可疑胃癌活检标本的HRME图像进行预诊断, 评估HRME对胃癌病理分型的诊断价值。
采用SPSS 17.0统计软件, 分析HRME对胃癌分型诊断的敏感性、特异性、准确性、阳性预测值和阴性预测值。HRME预诊断结果与病理诊断结果的一致性分析采用Kappa分析。
共纳入50例, 其中, 贲门5例, 胃底7例, 胃体13例, 胃角9例, 胃窦16例; 隆起型15例, 溃疡型35例。共采集4047帧HRME图像, 经筛选获取820帧用于研究。
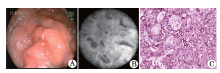
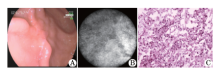
根据1.2.6建立的诊断标准, 将胃癌组织的HRME图像分为分化型和未分化型。分化型胃癌表现为正常胃小凹形态消失, 取而代之的是结构紊乱的异型腺体, 腺体不规则、大小不一、排列紊乱(图2); 未分化型胃癌表现为正常胃小凹结构消失, 亦无结构紊乱的腺体(图3)。
40例可疑胃癌活检标本中, HRME诊断与组织病理结果见表1, HRME诊断胃癌的敏感性、特异性、准确性、阳性预测值、阴性预测值分别为96.7%、70.0%、90.0%、90.6%、87.5%, 一致性检验Kappa值为0.71。根据分化型和未分化型胃癌的HRME诊断标准, HRME诊断为分化型胃癌15例, 未分化型胃癌14例, 与病理诊断的符合情况见表2。因此, HRME对胃癌分型诊断的敏感性、特异性、准确性、阳性预测值、阴性预测值分别为80.0%、85.7%、82.8%、85.7%、80.0%。
| 表1 可疑胃癌组织的HRME诊断结果与组织病理结果 |
| 表2 不同分型胃癌的HRME诊断结果与组织病理结果 |
胃癌患者的预后与其组织病理分型和分化程度相关[3]。于颖彦[4]进行的胃癌分型与预后关系的荟萃分析显示:低分化胃癌患者术后5年死亡危险性是高分化的2.01倍、中分化的1.58倍, 中分化胃癌患者术后5年死亡危险性是高分化的1.47倍。因此, 胃癌的组织病理分型在判断预后上仍是一个重要的参考指标。内镜检查加活检组织病理学检查是诊断胃癌及判断病理分型的最准确最可靠的方法, 但活检存在诸多不足, 因此, 需要能够简单、快速、有效检测病变的新技术。
HRME是一种新兴的显微内镜成像方式, 已广泛应用于多种病变的诊断与鉴别诊断, 获得了良好的诊断价值, 且HRME简单易学, 经过短暂的培训, 没有经验的HRME诊断医师能够达到较高的诊断特异性和稳定的组间一致性[5, 6]。此外, 一些软件的开发应用, 使得HRME的操作更加简便、精确, 例如利用自动帧选软件能够从HRME视频序列中得到没有运动伪影的高质量图片, 节省人工操作的时间[7]; 利用软件定量分析HRME图像中细胞核大小、核质比、腺体大小等指标, 能够更加精确地区分病变, 减少主观因素的影响[8]; 利用视频拼接技术能够清晰的观察病变的边界[9]。目前, HRME已经应用于食管和结肠, 如食管肿瘤的诊断[10, 11]、结肠息肉的良恶性鉴别等[12, 13], 获得了较高的诊断准确性和特异性。
本研究以组织病理学诊断为金标准, 总结胃癌的HRME图像特点, 建立不同分型胃癌的HRME诊断标准。研究结果显示, HRME对胃癌分型诊断的敏感性、特异性、准确性都在80%以上, 表明对于不同分型的胃癌具有较高的诊断价值。
HRME仍存在一些不足:(1)HRME图像的质量受较多因素影响, 如坏死组织、黏液、运动伪影、活检标本的大小等。残留的坏死组织和黏液可能会掩盖原本存在的腺体, 使我们误认为是未分化型胃癌; 同时也可能形成腺体样结构, 使我们误认为是分化型胃癌。(2)HRME成像深度有限, 不能像CLE那样进行光学切片, 可能会对病变的诊断产生影响。另外, 本研究样本量较小, 尚需要大样本的研究来进一步验证HRME对胃癌病理分型的诊断价值。在今后的研究中, 笔者将进一步改进HRME设备, 寻找更好的处理标本及减少运动伪影的方法; 开发可以定量分析图像中细胞核大小、核质比、分布, 以及腺体的大小、分布的新软件。
总之, 本研究表明HRME对于胃癌的病理分型具有较好的诊断价值。将HRME与内镜检查相结合, 能够更早地为临床医师制定治疗方案、判断预后提供参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|