作者简介:李瑞海,本科学历,主任医师。
主-肺动脉间隔缺损(aorto-pulmonary septaldefect, APSD), 又称主-肺动脉窗, 是一种少见的先天性心脏病, 其发病率占先天性心脏病0.1%~0.2%。由于该病发病率低, 临床罕见, 早期易误诊、漏诊, 并且早期容易出现肺动脉高压, 手术危险性大, 病死率高。2012-5至2015-12, 我院手术治疗4例APSD合并肺动脉高压患者, 取得满意效果。
4例中, 男1例, 女3例, 年龄6~21岁, 其中2例由于在活动后出现心悸、气短而就诊, 2例由于出现间断性咳鲜血就诊。所有患者均出现活动耐力下降, 容易上呼吸道感染、发热, 剧烈活动后出现口唇轻度发绀, 3例在静息状态下无口唇和指端发绀, 1例有口唇和指端轻度发绀和杵状指, 4例均在胸骨左缘第2、3肋间可闻及2~3级收缩期杂音。
4例均多次行超声心动图检查, 按照Richardson分型法, Ⅱ 型1例, 主-肺动脉窗口在主动脉与左右肺动脉分叉处, Ⅲ 型3例, 右肺动脉均起源于主动脉, 均合并动脉导管未闭, 1例同时合并卵圆孔未闭, 肺动脉收缩压70~130 mmHg, 动脉水平双向分流, 经过口服降肺动脉压靶向药物治疗6~14个月, 肺动脉收缩压降至50~105 mmHg。
右心导管检查仍然是诊断肺动脉高压的金标准, 也是判断手术指征的重要方法, 4例患者在服用降肺动脉压靶向药物治疗前后均多次行右心导管检查。服药后、术前吸氧前后导管检查结果见表1。
| 表1 4例右心导管检查吸氧前后相关数值对比 |
4例均在全麻低温体外循环下完成手术, 建立体外循环前需充分游离主动脉、肺动脉间隙、左、右肺动脉, 体外循环开始转流时需要阻断左、右肺动脉, 预防灌注肺的发生, 经过主动脉根部灌注心脏停跳后, 3例Ⅲ 型患者将右肺动脉从主动脉壁上切断, 与主肺动脉相对应部位行端侧吻合, 3例动脉导管直接7-0丝线双重结扎+缝扎, 1例Ⅱ 型患者切开主肺动脉, 应用涤纶布+心包修补动脉导管, 切开主动脉应用涤纶布补片修补主肺动脉缺损窗, 同时在修补的涤纶布与自体心包制成, 只能右向左分流单向活瓣0.5 cm。
体外循环时间:85~185 min。主动脉阻断时间:45~124 min。在监护室呼吸机辅助呼吸时间:22~154 h。1例在术后出现持续性肺动脉高压, 间断出现肺动脉高压危象和恶性心律失常, 在术后第7天合并肺部感染死亡, 余3例存活。术后第7天复查超声心动图:提示肺动脉收缩压53~71 mmHg, 心包少量积液1例, 心包中量积液1例, 经过对症治疗吸收, 顺利出院。随访3~45个月, 术后平均服用降肺动脉压靶向药物治疗3~29个月, 经过复查超声心动图, 无肺动脉瓣上及吻合口狭窄, 心功能(NYHA)Ⅰ 或Ⅱ 级, 均恢复上学和从事日常家务劳动。
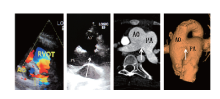
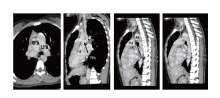
明确诊断APSD为在先天性心脏病中所占的比例较低, 大约0.11%[1, 2], 临床常规检查易误诊、漏诊[3]。因此, 对于双肺纹理不对称, 右肺动脉观察不清, 怀疑右肺动脉缺如或发育不良者, 应请有经验专科大夫行超声心动图检查, 超声提示主肺动脉直接延续为单侧肺动脉, 另一侧观察不清者, 应高度怀疑APSD。对于诊断不明者应用双源螺旋CT多能明确诊断[4, 5, 6, 7], 同时还应行右心导管检查, 用以判断有否手术指征。超声心动图和主动脉CTA截图见图1、2。
手术时机:本病未经外科治疗的患者, 70%于出生后6个月内死亡, 80%于1年内死亡[2, 8], 但也有报道1例未经治疗生存至47岁的大型APSD[9]。文献[10]报道了1例并Eisenmenger综合征, 未经治疗活到60岁的APSD女性患者, 超过了有Eisenmenger综合征的成年人最长平均寿命52.6岁。由于幼儿时期肺血管阻力较低, 来自主动脉高压血流直接进入异常起源肺动脉, 导致肺循环严重充血, 早期即出现严重的肺动脉高压。由于我国国情等特殊原因, 临床患者就诊大多较晚, 由于左心室无效做功及明显增加的后负荷, 极容易导致左心室心力衰竭, 早期严重肺动脉高压及由此产生的三尖瓣大量反流又极易导致右心衰继发患侧肺组织血流动力学改变后, 健侧肺神经反射性肺血管持续性痉挛, 导致肺血管阻塞性病变常累及双肺[11, 12]。这类患者远期疗效主要取决于肺血管床的病理状态[13], 因此, 应该早期诊断、早期治疗, 早期手术可以防止充血性心衰和肺血管阻塞性病变[14, 15]。术者应综合判断手术时机, 对末梢氧饱和度≥ 96%、周围动脉氧分压≥ 70 mmHg、Qp/QS≥ 1.5、肺血管阻力≤ 10 Wood, 世界卫生组织肺动脉高压功能分级, 是根据临床症状分级的[16], 对Ⅰ ~Ⅱ 级患者可以手术治疗, 而肺病理活检是术中, 开胸后先打开一侧胸膜腔, 切取1 cm左右肺组织送病理检查, 否则, 对于Ⅲ ~Ⅳ 级患者应继续口服单一降低肺动脉压靶向药物治疗或序贯联合治疗[17, 18, 19], 3个月或更长时间, 其可以改善肺血流动力学, 延长6 min步行距离, 改善心功能和延长生存时间[20]。术前必须再次行右心导管检查, 经过筛选符合上述条件再手术治疗[21], 否则, 贸然手术会加快死亡。
本组中死亡的1例Ⅱ 型APSD患者, 肺动脉高压功能分级Ⅲ 级, 术中肺活检亦为Ⅲ 级, 轻度杵状指并在静息状态下出现口唇和指端轻度发绀, 开始口服西地那非单药治疗6 h, 复查右心导管检查疗效不明显, 联合口服波生坦治疗14 h, 右心导管检查经过吸氧试验, 末梢氧饱和度94%, 平均肺动脉压下降> 20%, 但全肺阻力仍然在19.28 Wood, Qp/Qs 1.15, 由于早期缺乏治疗经验, 经过家属反复哀求下手术治疗, 术中修补主-肺间隔缺损涤纶补片上留有0.5 cm单向活瓣, 在术后反复出现肺动脉高压危象、恶性心律失常、低心排, 甚至出现体循环血压和肺循环血压倒置, 静脉持续泵入前列地尔、瑞莫杜林, 胃管定期注入降肺动脉压靶向药物, 呼吸机管道吸入一氧化氮等综合措施, 无法降低呼吸机条件、减低吸入氧浓度, 术后第7天因肺部感染加重肺动脉高压导致患者死亡, 因此, 对右心导管检查不符合上诉条件, 不应贸然手术。
围术期管理主要要求:术前需要严格掌握手术适应证和手术时机, 术中尽量缩短体外循环时间等, 并注意心肺功能的保护[22, 23]。术后早期需要充分镇静, 尽量减少对患者不良刺激, 快速轻柔吸痰, 呼吸机辅助呼吸, 采取过度通气方法, 必要时可以应用呼气末正压4~8 cmH2O PEEP, 同时吸入6~8 ppm一氧化氮[24, 25]。前列地尔、米力农持续微量泵静脉泵入, 尽早把患者术前口服的降低肺动脉压靶向药物由胃管内注入; 对于重度肺动脉高压患者可以应用瑞莫杜林微量泵持续静脉泵入。多数患者经过20~48 h积极治疗, 可以脱离呼吸机拔出气管插管。对于术后超过5 d仍无法脱离呼吸机患者可以行气管切开, 从术后第1天开始每天早上行痰细菌培养和药物敏感试验, 根据药敏试验及时调整应用敏感抗生素治疗。由于这类患者应激性强, 为减轻体外循环对肺部影响减少渗出, 在体外循环开始及术后第1天应用甲泼尼龙冲击治疗1~2次。术后需要继续服用降肺动脉压靶向药物一种或多种联合治疗0.5~2年, 甚至更长时间; 氧疗, 避免劳累, 避免剧烈运动, 积极预防和治疗上呼吸道感染; 年轻女性注意避孕等[11, 15]。
总之, APSD在先天性心脏病中所占的比例较低, 早期没有特殊表现, 临床工作中易误诊、漏诊, 而就诊较晚的患者多合并中重度肺动脉高压, 患者远期疗效主要取决于肺血管床的病理状态[13]。因此, 应该早期诊断、早期治疗, 早期手术是可以防止充血性心衰和肺血管阻塞性病变的关键[26, 27]。对右心导管检查不符合上诉条件, 暂不具备手术适应证, 不应贸然手术治疗, 而应继续服用降肺动脉压靶向药物治疗3个月以上, 再行右心导管检查, 达到上述手术指征者才手术治疗[21]。只要手术适应证、手术时机掌握得当, 术中注意心肺功能保护, 围术期加强监管, 术后早中期疗效良好。由于病例数较少, 远期疗效有待进一步观察。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|