作者简介:李 华,本科学历,主任药师。
目的 对颜生胶囊中阿魏酸进行定性鉴别与含量测定。方法 采用薄层色谱法鉴别当归、川芎及阿魏酸,采用高效液相色谱法测定阿魏酸含量。色谱条件:色谱柱Kromasi1 5u 100A C18,250 mm×460 mm,流动相:甲醇-1%冰乙酸溶液(30∶70),室温,检测波长320 nm。结果 定性薄层鉴别结果表明,采用硅胶G薄层,以环己烷-二氯甲烷-冰乙酸(16∶16∶2)为展开剂,在365 nm紫外灯下检视,斑点清晰,阴性无干扰;含量测定方法学研究表明,其他成分对阿魏酸测定无干扰,阿魏酸在0.25~1.50 μg/μl浓度范围内,线性关系良好( r=0.9995),精密度良好,对照品溶液及供试品溶液RSD分别为0.35%、0.73%,平均加样回收率99.22%,RSD为1.4%,供试品溶液在6 h内基本稳定。结论 该方法简便、准确、重复性好,可以作为颜生胶囊中当归、川芎的质量控制方法。
Objective To determine the content of ferulic acid in Yansheng capsules in order to provide reference for pharmaceutical production.Methods TLC was used to identify radix angelicae sinensis and rhizoma ligustici wallichii while high performance liquid chromatography(HPLC)was used for determination of ferulic acid. Chromatographic conditions for ferulic acid included a mobile phase composed of methanol and 1% ice acetic acid solution(30∶70), room temperature, and a detection wavelength of 320 nm.Results The result of TLC showed that the identification spots were clear and negative without any interference observed under a 365 mm UV-lamp using a silican gel layer and with ethane and ice acetic acid (16∶16∶2) as the solvent. Ferulic acid showed a good linearity and precision within the rangeof 0.2515-1.509 μg/μl, r=0.9995. The RSD of the constrast solution and the supplied test-solution was 0.35% and 0.73%, respectively. The average recovery was 99.22%, with an RSD of 1.4%. The supplied test-solution was basically stable within 6 hours.Conclusions This method is simple, accurate and reproducible, which can be used for quality control of Yansheng capsules.
颜生胶囊是由五味子、柏子仁、炒枣仁、夜交藤、红花、决明子、大黄、丹参、当归、川芎、何首乌、黄芪、威灵仙、火麻仁组成的复方制剂, 用于养心安神、活血调经、润肠通便、养颜驻容。本实验采用薄层色谱法和高效液相色谱法对颜生胶囊的主药当归、川芎及其中的阿魏酸进行定性鉴别与含量测定, 以控制制剂质量, 保证临床疗效。
三用紫外分析仪(天津天光光学仪器有限公司), DF-101S集热式恒温加热磁力搅拌器(河南省予华仪器有限公司), 高效液相色谱仪(岛津SCL-10AVP, SPD-10AVP, CAT.NO.228-40000-38), 色谱柱(Kromasi1 5u 100A C18, 250 mm× 460 mm)、电子天平(AL204和AB135-S)。
五味子, 柏子仁, 炒枣仁, 夜交藤, 红花, 决明子, 大黄, 丹参, 当归, 川芎, 何首乌, 黄芪, 威灵仙, 火麻仁; 颜生胶囊(武警内蒙古总队医院提供); 阿魏酸对照品(中国食品药品检定研究所, 编号110773-201313, SYD-14YX)。
乙醚、甲醇(天津市风船化学试剂科技有限公司)、环己烷(天津市福晨化学试剂厂)、冰乙酸(北京北化精细化学品有限责任公司)、二氯甲烷(天津市光复科技发展有限公司)、稀盐酸(天津市化学试剂三厂)、碳酸氢钠、碳酸钠(天津市永大化学试剂有限公司); 硅胶(青岛裕民源硅胶试剂厂), 羧甲基纤维素钠(沈阳化学试剂厂)。
2.1.1 薄层板的制备 取5 g硅胶G与0.5%CMC-Na的滤液按1∶ 3比例混合。研磨均匀后, 涂布于玻璃板上(10 cm× 15 cm或20 cm× 20 cm), 厚度为0.25 mm, 室温干燥后, 置烘箱中于105 ℃活化30 min, 置干燥器中, 放冷, 备用[1]。
2.1.2 阿魏酸的提取分离方法
方法a:取当归对照药材粉末和川芎对照药材粉末各2 g, 加1%碳酸氢钠溶液50 ml, 超声处理20 min, 离心15 min, 取上清液用稀盐酸调pH至2~3, 用乙醚振摇提取2次, 每次20 ml, 合并乙醚液, 分别点样10 μ l, 展开。
方法b:取当归对照药材粉末和川芎对照药材粉末各2 g, 加5%碳酸钠溶液30 ml, 超声处理40 min, 滤液用乙醚萃取, 弃乙醚层, 用稀盐酸调pH值至1~2, 再用乙醚提取3次, 每次15 ml, 合并乙醚液, 分别点样10 μ l, 展开。
方法c:取当归对照药材粉末和川芎对照药材粉末各2 g, 加稀盐酸80 ml于500 ml烧杯中。超声处理40 min后, 离心15 min, 取上清液, 用乙醚提取2次每次20 ml, 合并乙醚液, 分别制得当归(上)川芎(上); 残渣加少量水溶解, 用稀盐酸调pH至2左右, 乙醚萃取3次(30 ml, 20 ml, 20 ml), 合并乙醚液, 分别制得当归(下)、川芎(下), 同法制备颜生胶囊供试液, 分别点样10 μ l, 展开。
方法d:取当归对照药材粉末和川芎对照药材粉末各2 g, 置于锥形瓶中, 加甲醇适量, 超声30 min, 分取甲醇液, 水浴蒸干。残渣加少量水溶解。用稀盐酸调pH至2左右, 乙醚萃取3次(30 ml, 20 ml, 20 ml)。合并萃取液, 回收乙醚, 残渣用少许甲醇溶解, 得对照药材溶液, 分别点样10μ l, 展开。
2.1.3 对照品、颜生胶囊供试液、阴性对照的制备 精密称取阿魏酸对照品5.4 mg, 置于100 ml 容量瓶中, 加甲醇溶解并稀释至刻度, 摇匀。即得54 μ g/ml阿魏酸的对照品溶液。将颜生胶囊以及去掉含有阿魏酸的当归、川芎两味药材的阴性对照制剂, 分别按方法d制作, 得到颜生胶囊样品溶液、阴性对照溶液。
2.1.4 薄层色谱条件 照薄层色谱法试验[2], 分别吸取阿魏酸标准品溶液、当归对照药材溶液、川芎对照药材溶液、颜生胶囊样品溶液、阴性对照溶液各10 μ l, 点于薄层板上, 将点样后的薄层板置于环己烷-二氯甲烷-冰乙酸(16∶ 16∶ 2)为展开剂的饱和层析缸内饱和1.0 h, 展开, 置365 nm紫外灯下检视。
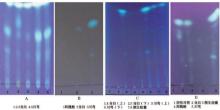
2.1.5 提取分离方法筛选结果 图1-A中, 以方法a提取当归与川芎对照药材后, 斑点可以分开; 图1-B中, 以方法b提取后的当归、川芎对照药材与对照品阿魏酸相应位置斑点不明显; 图1-C以方法c提取的样品, 点样展开后, 发现在残渣中也有阿魏酸; 图1-D中, 以方法d提取的样品在颜生胶囊样品与当归、川芎对照药材、阿魏酸对照品相应位置, 显相同颜色的斑点。故以方法d作为样品中阿魏酸的提取分离方法。
2.2.1 对照品溶液的制备 取阿魏酸对照品精密称取5.03 mg, 加甲醇溶解, 超声30 min, 甲醇定容至100 ml, 摇匀, 浓度为50.3 μ g/ml, 作为对照品溶液。
2.2.2 供试品溶液的制备 取颜生胶囊10粒, 去囊壳, 混匀, 精密称取内容物2 g, 置锥形瓶中, 加甲醇50 ml, 超声处理30 min, 分取甲醇液, 水浴蒸干, 残渣加20 ml水溶解, 并用稀盐酸调pH 1~2, 置分液漏斗中, 用乙醚萃取3次(30 ml、20 ml、20 ml), 合并乙醚萃取液回收乙醚至干, 残渣用甲醇溶解定容至25 ml, 得供试品溶液。
2.2.3 色谱条件 流动相为甲醇-1%冰乙酸水溶液(30∶ 70); 等度洗脱, 保留时间20.465 min, 流速1 ml/min; 柱温25 ℃; 进样量20 μ l, 检测波长320 nm。理论塔板数按阿魏酸峰计不低于3000。
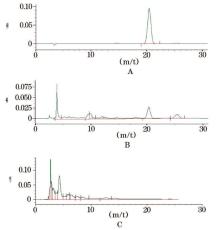
2.2.4 系统适用性实验 按颜生胶囊处方和制法, 制备缺当归和川芎阴性制剂, 精密称取2 g, 再按供试品溶液制备方法制备阴性对照溶液。进样20 μ l测定, 结果阴性样品在阿魏酸相同位置处无色谱峰, 表明对阿魏酸测定无干扰, 结果见图2。
2.2.5 线性关系考察 分别精密吸取对照品储备液(5.00 mg/100 ml), 分别在25 ml容量瓶中稀释成0.25、0.50、0.75、1.00、1.25、1.50 μ g/μ l, 按上述色谱条件进样测定, 以峰面积积分值A为纵坐标, 对照品浓度为横坐标, 作线性回归, 得回归方程Y=131443X+451980, r=0.9995(n=3), 结果表明, 阿魏酸在0.25~1.50 μ g/μ l浓度范围内线性关系良好。
2.2.6 精密度 精密吸取对照品溶液及供试品溶液各20 μ l, 分别重复进样5次, 结果见表1, 按上述色谱条件测定, 阿魏酸峰面积积分值相对标准偏差RSD分别为0.35%、0.73%, 结果表明, 精密度良好, 颜生胶囊供试品与阿魏酸对照品组比较, 无统计学差异。
| 表1 精密度试验结果 |
2.2.7 稳定性试验 取供试品溶液, 在0、1、2、4、6 h进样, 共进样5次, 按上述色谱条件分别测定, 结果见表2, RSD为1.6%, 表明供试品溶液在6 h内基本稳定。
| 表2 稳定性试验结果 |
2.2.8 含量测定 取供试品5粒, 分别定容至25 ml容量瓶中, 按“ 2.2.3” 条件测定, 5粒的含量分别为0.114、0.115、0.117、0.116、0.113 mg/粒, 平均含量0.115 mg/粒, RSD为1.4%。
2.2.9 加样回收率实验 取已知含量的样品1.0 g, 精密称定, 加入等量的阿魏酸对照品, 按供试品溶液制备项下的方法制备, 依法测定, 计算回收率, 结果见表3, 平均回收率为99.22%, RSD为1.4%。
| 表3 阿魏酸对照品加样回收率实验 |
颜生胶囊是由当归、川芎、红花、丹参、何首乌、黄芪、五味子、柏子仁、炒枣仁、夜交藤、决明子、大黄、威灵仙、火麻仁组成的复方制剂, 方中川芎与当归为君药, 二者均含有阿魏酸成分。2015版药典[3]中, 川芎仅以对照药材薄层色谱作为其鉴别的方法, 当归以对照药材和阿魏酸的薄层色谱作为其鉴别方法, 同时以高效液相色谱法作为其阿魏酸定量的指标。因此, 在制定质量标准中, 选择当归、川芎对照药材和阿魏酸作为定性成分, 阿魏酸作为定量指标成分。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|