作者简介:王剑杰,硕士,主治医师。
原发性肝血管肉瘤(primary hepatic angiosarcoma, PHA)始发于肝内间叶组织, 是最常见的原发性肝脏肉瘤, 约占原发性肝脏肉瘤的36%[1], 占肝内恶性肿瘤的2%[2], 侵袭性极强。由于PHA患者无明显症状, 影像学表现缺乏特异性, 临床误诊率较高。笔者探讨PHA的PET/CT代谢特点及病理学表现, 旨在加深临床医师对该病的认识。
搜集2012-02至2016-02在武警总医院就诊并经病理证实的4例PHA患者临床和影像学资料。其中男1例, 女3例, 年龄28~65岁, 平均44岁。临床表现:右上腹不适伴恶心、呕吐2例, 食欲缺乏、消瘦1例, 全身乏力伴低热1例。体格检查:3例肝肿大, 除1例有乙型肝炎病史, 其余病例均无肝炎、肝硬化及明确致瘤毒物接触史。1例有氯乙烯长期接触史。实验室检查:血清学化验CEA、AFP、CA199、CA125水平均在正常范围。
采用德国Siemens的Biograph mCT PET/CT扫描仪, 18F-FDG由中国原子高科公司北京同位素所提供, 放化纯度> 95%。受检者空腹6~8 h, 测定血糖水平控制在7.3 mmol/L以下, 按体质量静脉注射18F-FDG 0.12 mCi/kg, 安静休息60 min。
PET/CT躯体扫描时, 检查范围自颅底至双侧股骨上段, 受检者双臂上举; 先进行CT平扫, 参数:层厚5 mm, 螺距1.2, 管电压120 kV, 管电流大小由设备自动设定; 随后行3D模式PET数据采集, 2 min/床位, 矩阵128× 128; 利用CT透射扫描数据对PET图像进行衰减校正, PET图像的重建采用迭代法, PET和CT重建图像间隔均为3 mm。
PET/CT图像由3位高年资核医学诊断医师阅片, 同机CT显示肝实质类圆形或不规则形密度减低灶, 根据病灶对FDG摄取高低不同, 分3类:放射性分布高于、等于和低于正常肝脏放射性本底, 目测法测量所有肉眼可识别病灶, 并参考同期增强MRI寻找对应肝脏病灶; 采用感兴趣区(region of interest, ROI)技术, 测量所有病灶最大标准化摄取值(maximal standard uptake value, SUVmax)。
增强MRI图像由2位高年资的MRI诊断医师参与分析, 观察肿瘤的部位、形态、大小、边缘、囊性变、坏死、强化程度及方式。
手术切除标本常规切开, 使用10%甲醛溶液固定, 石蜡包埋, 常规HE染色及免疫组织化学染色, 常规显微镜观察。
1.5.1 一般表现
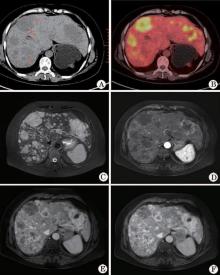
单发巨块型1例, 多发结节型3例(图1), 混合型(多发巨块伴结节状子灶)0例。多发结节型, 病灶呈类圆形, 大部边界较清, 直径范围0.5~6.2 cm, 直径范围为3.8~6.4 cm。
1.5.2 FDG PET/CT代谢表现 CT平扫各病灶呈不均匀低密度或略低密度影, 3例多发结节型肿瘤弥漫分布于肝左右叶, 分布无明显规律; 直径3.0 cm以上的主灶表现为略低密度, 中心见斑片状更低密度区(图1A)。1例巨块型肿瘤病灶中心见不规则斑片状更低密度影, 其边缘区域见斑点样高密度钙化影。PETCT融合图像示:呈现多样性, 肿瘤的FDG代谢程度以等、高摄取表现为主, 以肝脏放射性本底为参照, 大多数瘤灶代谢程度高于肝脏放射性本底(SUVmax范围4.5~18.5), 少部分病灶代谢程度低于肝脏本底(SUVmax 2.6~4.1), 中心区见斑片状放射性稀疏区(图1B红色长箭及短箭)。
1.5.3 MRI增强表现 平扫MRI示各病灶T1WI呈低信号, T2WI呈不均匀高信号(图1C), MRI动态增强示: 多发结节型瘤灶增强动脉期边缘呈轻-中度斑片状强化(图1D), 门静脉期持续强化且强化范围扩大(图1E), 延迟期呈持续向心性填充, 与周围肝实质相比, 呈高信号, 病灶中心区可见无强化区(图1F)。个别病灶延迟期可呈现离心状增强, 或增强各期无明显强化。1例巨块型病灶动脉期及门脉期呈边缘花环状不均匀强化, 中心区结节样伴条索样强化, 延迟期呈进行性填充, 病灶周边伴“ 假包膜征” , 中心坏死区未完全填充。本组1例多发结节型肿瘤正确诊断, 因其强化方式有特征性; 其余3例均误诊(1例巨块型诊断为巨块型肝癌, 2例诊断为转移瘤)。
1.5.4 病理表现 大体标本多呈不规则块状、类圆形, 切面实性或呈囊实性、海绵状, 内可伴血栓形成和坏死。镜下:瘤细胞呈梭形、多边形, 核大深染, 病理性核分裂易见; 瘤细胞沿肝细胞索表面呈覆盖性生长, 瘤细胞突入海绵状扩张的血管腔(图2A)。
免疫组化:4例CD34(+~+++), 3例CD31(+~+++), 1例FⅧ (+); 其余指标阴性(图2B)。
PHA是起源于肝窦血管内皮细胞的恶性肿瘤, 进展迅速, 多见于成年, 发病高峰期为50~70岁, 病因及发病机制尚不十分清楚[3]。PHA缺乏特异性的肿瘤标记物, 本组肿瘤指标均无异常。临床表现无明显特异性, 可有腹胀、乏力、纳差等; PHA恶性程度较高, 预后较差。
PHA病理上按形态学分为巨块型、巨块结节混合型、弥漫性多结节型、弥漫性微小结节型四种。Rademaker等[4]认为, 国外PHA以弥漫多结节型多见; 而国内报道以单发巨块型较多[5]。
本组PHA巨块型1例和多发结节型3例, CT平扫表现为不均匀略低密度影, 中心坏死区呈更低密度。PHA内部易出血, 其原因在于肿瘤细胞形成不成熟的血管样结构, 同时存在内源性凝血因子消耗[6]。PHA钙化不常见, 本组仅1处病灶边缘见砂砾样钙化。
MRI具有较高的软组织分辨率, 比平扫CT可提供更多诊断信息, 尤其对于囊变、出血的识别, 敏感性高。既往研究报告显示PHA强化方式各异, Kim等[3]、郑红伟等[7]报道显示, PHA典型增强MRI表现为动脉期边缘区呈乳头状、团片状、结节状明显强化, 静脉期进行性填充强化; 延迟期有继续填充趋势, 但大多不能完全填充; 此型强化为富血供型, 病理多见于巨块型或混合型、也见于多发结节型; 本组3例多发结节型病灶占60%以上病灶为类似的强化方式。1例巨块型病灶表现为边缘明显环形或乳头状强化。富血供型肿瘤表现为静脉期向中心区域填充强化, 动脉期周边呈不规则明显强化, 中心区索条状或结节状动脉期明显强化, 对诊断PHA具有一定特征性[8]; 可能与肿瘤血管、细胞及纤维组织共同构成的间壁样结构有关, 或供血动脉深入肿瘤内部伴动静脉短路有关。
富血供病灶多表现FDG代谢略高于或接近肝脏放射性本底, 以多发结节型病灶表现相对显著; 分析可能与肿瘤组织血管生成较多、血液供应充足, 瘤内无明显缺血缺氧, 葡萄糖进入肿瘤细胞后滞留较少, 或细胞葡萄糖利用率偏低有关; 该型瘤灶病理, 肿块标本切面多呈暗褐色, 质脆, 包含实性部分和充满血液的海绵状、裂隙状囊腔结构, 管壁间隔胶原增生, 局部乳头状突入管腔内部, 夹杂肿瘤血管和纤维组织腔内, 故表现为早期明显强化伴延迟填充强化。
文献[9, 10]报道, PHA表现为动脉期周边多中心或环形、斑片状或结节样轻度强化, 延迟进行性填充强化, 后期呈不均匀低信号; 为乏血供型, 此型多见于多发结节型、弥漫微浸润型。本组3例多发结节型肿瘤部分病灶表现小结节样或边缘区轻度强化, 延迟期进行性强化。分析其病理资料, 瘤灶标本切面以灰白色实性肿瘤组织为主, 伴细小囊腔样结构, 肿瘤细胞沿原有的血管腔隙呈巢团状生长, 排列紧密, 血管腔样结构及细胞间隙样结构变窄变少, 血供较少, 因而表现为轻度强化; 同时大部分管壁间隔胶原增生, 纤维成分增加, 导致对比剂外渗延迟, 表现为持续填充强化。另外, 肿瘤组织因排列紧密, 间质血管变窄, 缺血缺氧, 瘤细胞摄取葡萄糖后滞留在细胞内较多, 无氧酵解增加, 因而呈现高摄取; 另外, 肿瘤有多支动脉供血, 并有动静脉短路, 以边缘分布为主, 因而动脉期肿瘤边缘可见多中心强化。
总体来讲, PHA多表现为富血供肿块, 但少数分化差的病灶血供较差, 坏死区域较大, 可表现为乏血供肿块, 诊断难度较大。本组4例病例, 仅1例因强化特征较为典型而正确诊断。
(1)肝细胞肝癌:典型者血供丰富, 动脉期明显强化, 呈“ 快进快出” 型强化; (2)海绵状血管瘤:边界清楚, 动脉期周边部呈明显结节状强化, 程度一般高于PHA, 中心区一般不出现索条状或结节状强化; (3)肝上皮样血管内皮细胞瘤:为低度恶性肿瘤, 多见于中年女性, 增强表现为类似血管瘤向心性强化模式, 影像上可表现出“ 包膜回缩征、棒棒糖征” ; (4)胆管细胞癌:动脉期周边部轻中度强化, 延迟期中心区强化, 常伴有胆管扩张、肝叶萎缩或肝被膜皱缩; (5)其他间叶源性恶性肿瘤如恶性纤维组织细胞瘤等难以鉴别, 确诊有赖于活检。
综上所述, PHA病理组织构成的多变性, 决定了其FDG代谢和MRI增强表现的多样性; PHA主要以FDG代谢增高为主, 典型者表现为富血供, 动脉期呈多结节样或环状明显强化, 伴中心结节样、索条状明显强化, 延迟期进行性填充。结合临床特定致癌物接触史、病程进展迅速的特点, 对术前做出正确诊断具有重要意义。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|