目的 探讨左卡尼汀对大鼠横纹肌溶解急性肾损伤的保护作用及其作用机制。方法 48只大鼠,随机分为空白组、模型组、盐水治疗组及左卡尼汀治疗组。肌内注射50%甘油建立横纹肌溶解急性肾损伤模型,盐水治疗组、左卡尼汀治疗组分别腹腔注射生理盐水和左卡尼汀。测血清肌酸激酶(creatine kinase,CK)、尿素氮(urea nitrogen,BUN)和肌酐(serum creatinine,Scr)水平,光镜下观察肾脏病理;RT-PCR和免疫组化分别检测肾脏TLR4、NF-kB;酶联免疫吸附法检测肾脏IL-6、TNF-α。结果 与空白组相比,模型组及盐水治疗组CK、BUN、Scr、TLR4、NF-kB、IL-6、TNF-α及急性肾小管坏死(acute tubular necrosis,ATN)评分均明显升高( F=9.12~211.77, q=5.40~20.3, P<0.05);与模型组相比,左卡尼汀治疗组CK、BUN、Scr、TLR4、NF-kB、IL-6、TNF-α及ATN评分水平明显降低( q=4.37~16.03, P<0.05)。结论 左卡尼汀缓解横纹肌溶解急性肾损伤的机制可能与其抗免疫炎性反应通路TLR4/NF-kB有关。
Objective To observe the renal function and the effect of L-carnitine on rhabdomyolysis-induced acute kidney injury(AKI) in rats.Methods Forty-eight adult rats were randomly divided into control group,model group, normal saline treatment group,and L-carnitine treatment group.50% glycerol was intramuscularly injected into double hind limbs of rats to prepare the rhabdomyolysis-induced AKI model.Normal saline treatment group and L-carnitine treatment group were intraperitoneally injected with saline and L-carnitine.An automatic biochemical analyzer was used to test levels of serum creatine kinase(CK),urea nitrogen(BUN) and creatinine(Scr) whileRT-PCR method and immunohistochemical method were employed respectively to detect the expression of TLR4、NF-kB in the kidney. Biotin method of enzyme linked immunosorbent assay(ELISA) was used to detect the expression of IL-6 and TNF-α in the kidney.Results In model group, levels of CK、BUN、Scr、TLR4、NF-kB、IL-6 and TNF-α were significantly elevated compared with control group( F=9.12-211.77, q=5.40-20.3, P<0.05).Compared with model group, levels of CK,BUN,Scr,TLR4,NF-kB,IL-6 and TNF-α were reduced significantly in L-carnitine group( q=4.37-16.03, P<0.05).Conclusions L-carnitine can ameliorate rhabdomyolysis-induced acute kidney injury, which may be related to its anti-inflammatory effect.
横纹肌溶解(rhabdomyolysis, RM)是由于外伤或非外伤所致的横纹肌被破坏, 继而引起内环境紊乱的一组临床综合征, 常可引起急性肾损伤(acute kidney injury, AKI), 重者可危及生命[1, 2, 3, 4, 5]。因此, 寻找一种能有效缓解RM致AKI预后的药物具有重要的临床意义。左卡尼汀(L-carnitine)是机体的一种特殊氨基酸, 其基本生理功能是转运长链脂肪酸进入细胞线粒体, 进行β 氧化为机体提供能量, 左卡尼汀可以减轻缺血、炎性反应递质等对肾组织细胞的损伤[6], 并且可以抑制炎性反应作用, 促进急性肾损伤的恢复。本研究主要探讨左卡尼汀对RM致AKI的保护作用及其作用机制, 旨在探讨左卡尼汀缓解横纹肌溶解急性肾损伤的机制可能与其抗免疫炎性反应通路TLR4/NF-kB有关。
将48只成年雄性大鼠随机分为空白组、模型组、盐水治疗组及左卡尼汀治疗组, 每组12只。空白组:不予特殊处理; 模型组:双侧后肢肌内注射50%甘油(10 ml/kg), 余无特殊; 盐水治疗组:双侧后肢肌内注射50%甘油(10 ml/kg)同时及24 h后分别腹腔注射生理盐水(10 ml/kg); 左卡尼汀治疗组:双侧后肢肌注50%甘油(10 ml/kg)同时及24 h后分别腹腔注射左卡尼汀(200 mg/kg)。每组在第48、72、96 h处死各4只大鼠, 心内采血并留取肾脏组织, 1/4肾组织置于甲醛液固定行肾脏病理检查, 其余组织置于-80 ℃冰箱保存行RT-PCR、免疫组化、ELISA测TLR4、NF-kB、IL-6和TNF-α 。
1.2.1 血清指标检测 采用美国BeckmancoulterAU5400自动生化仪检测CK、Cr和BUN。
1.2.2 光镜下观察肾脏结构 严格按照石蜡切片一般步骤制作石蜡切片, 将切片进行HE染色, 采用奥林巴斯光学显微镜(日本Olympus公司BX51型)读片并采集图像。就光镜下HE染色标本, 对肾小管损伤进行评分, ATN评分标准:每张切片× 200倍镜下取10个视野, 0=正常, 1=轻微损伤(受损肾小管< 5%), 2=轻度损伤(受损肾小管5%~25%), 3=中度损伤(受损肾小管25%~75%), 4=重度损伤(受损肾小管> 75%), 半定量计算平均值, 作为肾小管损伤的评分指数。
1.2.3 免疫组化法测肾脏组织TLR4、NF-κ B 严格按照SABC法免疫组化染色, 采用奥林巴斯光学显微镜观察并采集图像, DAB显色显示阳性颗粒呈棕黄色。用积分综合计量法计算结果评价免疫组化结果。即每张切片× 200倍镜下取10个视野, 对染色强度进行评分:不着色记为0分, 浅黄色记为1分, 黄色记为2分, 棕黄色记为3分。每种阳性强度对应的值× 该强度细胞的百分比, 求和(1× 弱阳性百分比+2× 中等阳性百分比+3× 强阳性百分比), 0为阴性, 0~1.0为弱阳性, 1.0~1.5为中等阳性, 大于1.5为强阳性。
1.2.4 RT-PCR法测大鼠肾脏组织TLR4、NF-κ B 严格按照产品说明书步骤提取总RNA, 进行反转录, 再进行扩增反应, 将PCR产物行琼脂糖凝胶电泳(北京六一仪器厂, DYY-6D型), 采用凝胶图像分析系统(君意, JY04S-3C型)进行半定量分析。TLR4上游引物序列 TGGCATCATCTT-CATTGTCC, 下游引物序列CAGAGCATTGTCCTCCCACT, 退火温度57.8 ℃, 产物长度115 bp; NF-κ B上游引物序列CCCCCTGAGAAAGAAACACT, 下游引物序列TATCCTGAAACCCCACATCC, 退火温度57.8 ℃, 产物长度121 bp; 内参选用β -actin, 上游引物序列CCACACCCGCCACCAGTTCG, 下游引物序列CTAGGGCGGCCCACGATGGA, 退火温度66 ℃, 产物长度140 bp。
1.2.5 酶联免疫吸附法(ELISA)测肾脏组织TNF-α 、IL-6 严格按照试剂盒步骤操作, 利用紫外-可见分光光度计(北京普析通用仪器公司, T6新世纪190-1100NM型)及酶标仪(美国Bio-Rad公司, 1550型)等仪器测出标准品的浓度, 再根据标准品的浓度及对应的OD值计算标准曲线的直线回归方程, 再依据样品的OD值在回归方程上计算出其相对应的TNF-α 、IL-6样品浓度。
采用SPSS17.0统计软件进行数据分析。正态分布资料以
(1) 横纹肌溶解指标:与空白组比较, 模型组及盐水治疗组CK均明显升高(P< 0.05), 给予左卡尼汀后, CK则明显下降(P< 0.05, 表1)。(2)肾功能指标:与空白组比较, 模型组及盐水治疗组BUN、Cr均明显升高(P< 0.05), 给予左卡尼汀后, BUN、Cr则明显下降(P< 0.05, 表1)。
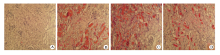
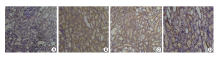
2.2.1 光镜观察 光镜下观察肾脏组织HE染色石蜡切片发现, 空白组:肾小球及肾小管结构完整, 细胞形态正常; 模型组及盐水治疗组:肾小球变大肿胀, 肾小管上皮细胞变性坏死, 管腔内有大量管型及细胞碎片, 间质有大量炎性细胞浸润; 左卡尼汀治疗组:肾小球结构基本完整, 肾小管结构尚完整, 细胞轻度变性、肿胀, 管腔内偶见渗出物(图1)。
| 表1 4组大鼠血清CK、BUN、Cr比较(n=4; |
2.2.2 急性肾小管损伤(ATN)评分 与空白组比较, 模型组及盐水治疗组ATN评分均明显升高(P< 0.05), 给予左卡尼汀治疗后, ATN评分明显下降(P< 0.05, 表2)。
| 表2 4组大鼠ATN评分统计(n=4; |
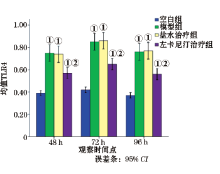
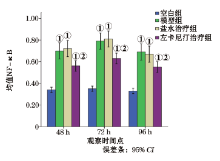
2.2.3 RT-PCR法测肾脏组织TLR4、NF-κ B 与空白组相比, 模型组和盐水治疗组TLR4、NF-κ B的mRNA含量明显升高(P< 0.05); 给予左卡尼汀治后, TLR4、NF-κ B的mRNA含量明显降低(P< 0.05, 图2、3)。
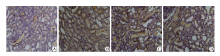
2.2.4 免疫组化法测肾脏组织TLR4、NF-κ B 与空白组相比, 模型组和盐水治疗组的TLR4、NF-κ B水平明显升高(P< 0.05); 给予左卡尼汀治后, TLR4、NF-κ B的含量明显降低(P< 0.05, 表3, 图4、5)。
2.2.5 ELISA法测肾脏组织TNF-α 、IL-6 与空白组相比, 模型组及盐水治疗组IL-6、TNF-α 均明显升高(P< 0.05), 给予左卡尼汀治疗后, IL-6、TNF-α 水平则明显下降(P< 0.05, 表3)。
| 表3 肾组织TLR4、NF-kB定量比较及IL-6、TNF-α 浓度(n=4; |
创伤或非创伤等因素造成的横纹肌溶解, 引起缺血后肌肉组织中的白三烯、血小板活化因子及补体因子炎性递质增高, 激活中性粒细胞, 引起肌肉损伤[2]。创伤可使机体生成大量炎性因子; 并进入血循环后引起瀑布样连锁反应, 导致全身炎性反应, 如毛细血管渗出、内皮细胞损害、微血管血栓, 最终导致微循环障碍, 加重肾脏等重要脏器的损害。
Toll样受体(Toll like receptors, TLRs)是和微生物识别相关的一个天然免疫受体家族, 是介导炎性反应的重要调节者[3]。Toll样受体4(TLR4)是发现最早及研究最多的TLRs相关蛋白, 其广泛分布于人体各组织脏器。TLR4是一种模式识别受体, 可通过识别并结合病原相关分子模式(pathogen-associated molecular patters, PAMPs)及损害相关分子(damaged-associated molecular patterns, DAMPs), 从而启动激活下游传导途径, 继而诱导免疫效应分子的表达, 包括诱导炎性递质的表达。TLR4/NF-κ B通路已被证实与多种炎性反应疾病相关[7]。文献[7]研究显示, 在TLR4被激活后, PAMPs及DAMPs刺激信号可以经过不同的途径传导激活下游信号NF-κ B, NF-κ B是由p50亚基及p65亚基(两个关键活性亚基)构成的异源二聚体, 是调控免疫炎性反应过程的核心转录因子[8]。正常生理状态下, NF-κ B及其抑制蛋白在胞浆中结合以抑制自身的核转位, 从而使自身处于失活状态, 当发生细胞应激时, NF-κ B可结合至炎性反应相关基因序列来调节转录, 继而引起包括IL-6、TNF-α 等炎性递质水平的增加[3, 4]。
Lee等[9]发现, TLR4及NF-κ B在小鼠缺血再灌注致AKI中表达明显升高, 证实了TLR4/NF-κ B通路参与缺血再灌注致AKI的发生发展。免疫炎性反应是缺血再灌注发生发展的重要病理机制, 同时免疫炎性反应也是AKI的病理机制之一[10], 提示TLR4参与了RM致AKI的发生发展。ZHENG Xiaoyong等[11]证实, TLR4参与缺血再灌注致AKI的发生发展。IL-6是一种急性期的炎性递质, 其在血清及组织中的含量与RM所致AKI严重程度相关[12]。文献[13]研究亦发现, 在肌注甘油引起AKI的模型中, 肾脏组织中的炎性反应递质表达均明显增加, 阻断或者抑制这些炎性递质的表达对RM致AKI具有保护作用。
左卡尼汀是脂肪代谢必不可少的辅助因子, 其主要作用是转运长链脂肪酸到线粒体基质中进行β 氧化以ATP的形式供应能量。有研究发现, 左卡尼汀能够通过减轻肾脏缺血再灌注损伤进而保护肾功能[14]。Aydogdu 等[15]证明, 左卡尼汀可以从功能、形态学、生物化学方面对RM致AKI具有保护作用。本研究通过腹腔注射左卡尼汀观察大鼠RM致AKI肾脏组织的TLR4、NF-κ B、IL-6、TNF-α 变化水平, 结果显示, 肌注甘油后, 模型组大鼠肾脏组织中的TLR4、NF-κ B、IL-6、TNF-α 水平明显上升, 差异具有统计学意义(P< 0.05), 证实了免疫炎性反应通路TLR4 /NF-κ B参与了RM所致AKI的发生及发展; 给予左卡尼汀治疗后, TLR4、NF-κ B、IL-6、TNF-α 水平则明显下降, 差异具有统计学意义(P< 0.05), 进一步证实了左卡尼汀可能是通过抑制免疫炎性反应通路TLR4/NF-κ B从而实现对横纹肌溶解急性肾损伤的保护作用。
综上所述, 本研究证实免疫炎性反应通路TLR4/NF-κ B参与了RM致AKI发生发展, 左卡尼汀对RM致AKI具有保护作用, 其机制可能与其抑制免疫炎性反应通路TLR4/NF-κ B继而减少下游炎性反应递质IL-6、TNF-α 水平有关。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|