作者简介:岳红红,博士,主治医师。
目的 对新型肺癌基因疫苗的免疫原性进行评价。方法 利用Furin 2A将黑色素瘤抗原A3(MAGE-A3)基因与GM-CSF基因进行连接,克隆入真核表达载体pVAX1,构建基因疫苗pVAX1- MAGE-A3-F2A-GM-CSF。将该疫苗体外转染293T细胞,利用免疫印迹和ELISA的方法对其表达情况进行检测。然后,将疫苗及对照组分别免疫接种小鼠,通过ELISA和ELISPOT法初步检测其诱导的体液免疫和细胞免疫反应。结果 成功克隆并构建了肺癌基因疫苗pVAX1- MAGE-A3-F2A-GM-CSF,并证实了其在真核细胞中表达。疫苗免疫接种小鼠模型后的检测结果显示,与空载体对照组以及单独抗原组相比,pVAX1- MAGE-A3-F2A-GM-CSF能够诱导产生更强的体液免疫反应和细胞免疫反应。结论 pVAX1- MAGE-A3-F2A-GM-CSF能够同时诱导较强的体液免疫和细胞免疫反应,其抗肿瘤效应将通过进一步实验深入研究。
Objective To construct a recombinant lung cancer DNA vaccine with high expression antigen MAGE-A3 in lung cancer and to evaluate its immunogenicity.Methods MAGE-A3 genes were fused with GM-CSF by F2A and cloned into pVAX1 to construct the gene vaccine ppVAX1-MAGE-A3-F2A-GM-CSF. After the gene vaccine was transfected into 293T cells, the expression of the gene vaccine was detected by Western blot and ELISA. Then, the gene vaccine and the control group were injected into the mouse model, and the immune activity was detected by ELISA and ELISPOT.Results Gene vaccine pVAX1-MAGE-A3-F2A-GM-CSF was constructed, and the expression of the antigen was confirmed. After the mice were vaccinated with the gene vaccine, the test results of ELISA and ELISPOT showed that pVAX1-MAGE-A3-F2A-GM-CSF induced both humoral immune response and cellular immune response compared with the control group.Conclusions pVAX1-MAGE-A3-F2A-GM-CSF can induce both humoral immune response and cellular immune response, and its potential anti-tumor effect needs to be further studied.
肺癌是最常见的恶性肿瘤之一, 已成为死亡的首要病因。据统计, 每年新确诊肺癌达160 万, 每年有 140 万人死于肺癌[1]。 肺癌最常见的组织学类型是非小细胞肺癌 (nonsmall-cell lung cancer, NSCLC), 占肺癌总数的 81%, 有 60% 患者在就诊时已属进展期或难以治愈的Ⅲ b期或Ⅳ 期, 失去了手术机会, 预后极差[2]。寻找有效的治疗方法是当务之急。近年来, 随着靶向治疗和免疫治疗等新兴疗法的出现, NSCLC 的临床治疗取得了很大的进展。作为主动免疫治疗方式的基因疫苗由于其能够诱导强烈的细胞免疫应答, 在肿瘤的免疫治疗研究中成为热点之一[3]。在免疫治疗中, 靶抗原的选择对治疗的特异性和有效性具有重要的作用。MAGE-A3 在肺癌等多种肿瘤细胞表达, 是真正的肿瘤特异性抗原。MAGE-A3重组蛋白和免疫佐剂组成的蛋白疫苗用于肺癌治疗的研究已有报道。本研究将MAGE-A3基因与粒-巨噬细胞集落刺激因子 (granulocyte-macrophage colony-stimulating factor, GM-CSF)基因构建于同一个真核表达载体, 并对其诱导的体液和细胞免疫反应进行初步评价。
将MAGE-A3(GenBank:GI 29029622)的胞外段编码区和GM-CSF(GenBank序列号: M11220.1)的编码区基因之间以Furin /2A[弗林蛋白酶(Furin)/口蹄疫病毒2A多肽序列进行连接, 构成融合基因MAGE-A3-F2A-GM-CSF, 融合基因的上、下游分别引入酶切位点BamHⅠ 和 EcoRⅠ 。融合基因在Invitrogen公司进行全基因合成, 然后将其克隆至基因疫苗常用表达载体pVAX1, 获得基因疫苗pVAX1- MAGE-A3-F2A-GM-CSF。利用限制性内切酶的酶切和基因测序对基因疫苗进行鉴定。主要步骤:利用NEB公司的内切酶BamHⅠ (R0136V)和EcoRⅠ (R0101V), 对获得的基因疫苗进行酶切, 能够切下与目的基因MAGE-A3-F2A-GM-CSF大小一致的条带, 即为构建成功。
为了验证pVAX1- MAGE-A3-F2A-GM-CSF的真核表达情况, 利用Invitrogen公司提供的脂质体2000将其转染至293T细胞(购于协和细胞库), 分别收集细胞培养上清液和六孔板中的细胞进行检测。转染简要步骤如下:转染前一天, 将对数生长期的293T细胞接种于6孔培养板, 到转染时的细胞汇合度应达到80%; 利用无血清培养基分别配置转染A液和B液, A液含有10 μ l的转染试剂, B液含有4 μ g的转染级质粒, A和B液在室温下放置5 min后, 将A液加入到B液中, 此为C液, 轻柔混匀, 室温放置20 min。将C液小心的加入到含有2 ml培养基和80%汇合度细胞的6孔培养板中, 轻柔混匀, 置于细胞培养箱孵育5 h。孵育结束后, 用新鲜培养基洗涤6孔板中的细胞, 最后加入2 ml新鲜的完全培养液。转染48 h后, 进行检测。为了检测MAGE-A3的表达, 将收集的转染细胞洗涤后, 用RIPA (Radio Immunoprecipitation Assay)裂解液裂解细胞, 十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electropheresis, SDS-PAGE)方法将细胞蛋白进行分离并转移到聚偏二氟乙烯 (polyvinylidene fluoride, PVDF)膜上, 然后以鼠源抗人MAGE-A3抗体(Abcam公司)和HRP标记的山羊抗小鼠IgG(北京中杉金桥生物技术公司)分别为一抗和二抗, 并分别孵育, 通过化学发光试剂 (electrochemiluminescence, ECL)显色, 并用化学发光仪拍照。GM-CSF是分泌表达, 所以将转染细胞培养上清液包被于96孔微板中, 采用鼠源的抗人GM-CSF单克隆抗体(Abcam公司)作为一抗, 二抗为辣根过氧化物酶(Horseradish Peroxidase, HRP)标记的山羊抗小鼠IgG(北京中杉金桥生物技术公司), 显色并终止反应后, 酶标仪检测(美国伯乐公司, 型号:Bio-Rad imark)波长在OD450处的吸光度值, 样品孔数值大于等于阴性孔数值2倍以上, 认定为阳性。
4~6周龄的雌性BalB/c小鼠购自于北京维通利华实验动物技术公司, 体重20~25 g, 实验动物的喂养按照“ 实验动物的护理和使用指南” 的要求执行。32只实验小鼠随机分为4组(配对比较法随机分组), 空白对照组、空质粒pVAX1组, pVAX1- MAGE-A3组和pVAX1- MAGE-A3-F2A-GM-CSF组, 每组8只。每只小鼠肌肉注射50 μ g质粒, 并进行电穿孔刺激, 分别在一免后的第7天和第14天加强免疫。末次免疫后的第14天, 处死小鼠后进行免疫原性检测。
免疫结束后2周, 分离血清, 小鼠眼眶取血100 μ l左右, 室温下自然沉淀2~3 h, 然后1500 r/min, 离心5 min后分离血清, 检测小鼠血清中的抗体滴度。将l0 μ g重组MAGE-A3抗原(Abcam公司)包被于96孔微板中, 然后加入系列稀释的各实验组小鼠血清, 孵育洗涤后, 加入HRP标记山羊抗小鼠IgG抗体, 孵育洗涤后, 3, 3', 5, 5'-四甲基联苯胺溶液(Tetramethylbenzidine, TMB)显色, 反应终止后, 酶标仪OD450波长处读取数值。实验组OD450的数值大于等于阴性对照2倍为阳性。酶联免疫斑点试验(enzyme linked immunospot, ELISOPT)的实验步骤为:用抗IFN-γ 抗体包被PVDF板, 将分离的小鼠脾细胞分别加入到包被孔中, MAGE-A3抗原疫苗组加入MAGE-A3蛋白作为刺激物, 无刺激抗原的做为阴性对照, 阳性对照加入佛波酯(Phorbol ester, PMA), 具体操作过程按照ELISPOT试剂盒说明进行。
采用GraphPad Prism 5进行统计学分析, 组间比较采用方差分析, 以P< 0.05为差异有统计学意义。
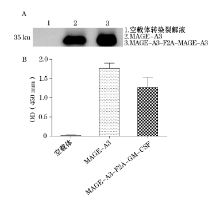
基因疫苗构建如前所述, 进行测序鉴定正确后, 将其转染293T细胞, 转染48 h后分别收获细胞和细胞培养上清液。收获的细胞裂解后转移至PVDF膜上后, 分别与鼠源抗人MAGE-A3抗体及HRP标记的山羊抗小鼠IgG进行孵育, 并经过ECL显色, 化学发光仪能检测到特异性条带, 表明MAGE-A3在293T细胞中能够表达(图1A)。GM-CSF是分泌表达, 可以用ELISA法检测转染后的细胞培养上清。将转染上清包被ELISA板孔以后, 用鼠源的抗GM-CSF单克隆抗体作为一抗进行孵育, 辣根过氧化物酶标记的山羊抗小鼠IgG作为第二抗体进行标记。通过TMB显色后, 检测表达情况。ELISA检测的结果显示, GM-CSF(图1B)检测组OD平均值明显高于空白对照组和空载体组, 证明GM-CSF在293T细胞内能够有效分泌表达。
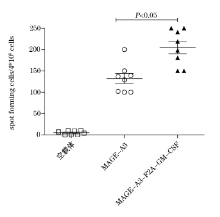
末次免疫后的第2周, 处死各实验组的小鼠, 并收集血清, 检测疫苗诱导的抗原特异性抗体反应。将各组血清进行系列稀释后, 与包被于微板上的MAGE-A3蛋白抗原进行孵育, 孵育结束后, 用辣根过氧化物酶标记的二抗进行标记, 酶标仪读数。结果如图2A所示, 单独抗原组pVAX1- MAGE-A3和融合抗原组pVAX1- MAGE-A3-F2A-GM-CSF都能产生一定强度的抗体反应, 然而融合抗原组pVAX1- MAGE-A3-F2A-GM-CSF诱导的抗体水平显著高于单独抗原组(P< 0.05)(图2B)。这个结果说明, 将MAGE-A3抗原与GM-CSF融合表达, 能够显著提高MAGE-A3诱导的特异性抗体的产生, 增强了体液免疫反应。
近年来, 肺癌的发病率在逐年提高, 尤其是非小细胞肺癌治疗难度较大。传统的肺癌治疗方法, 如放疗、化疗和手术等, 虽然能在一定程度上减轻病痛, 但是预后往往较差, 容易复发和转移。免疫治疗是发展非常迅速的肿瘤治疗的新型手段, 并取得了一些重要突破性进展[4]。其中肿瘤治疗性疫苗, 由于其能够诱导机体产生强烈的抗肿瘤免疫作用, 逐渐成为研究热点之一[5]。在治疗性疫苗的研究中, 由于以质粒DNA为载体的疫苗能够诱导强烈的细胞免疫, 如Th1和CTL杀伤反应[6], 其被多用于研发针对恶性肿瘤和一些慢性感染性疾病的治疗性疫苗。然而, 由于DNA疫苗的免疫原性较低, 其研究和发展受到了一定的限制, 曾经一度出现停滞不前的现象。但是, 自从将在体电脉冲转染这种高效的基因疫苗递送方式用于基因疫苗的免疫接种后, 其发展非常迅速[7]。当然, 提高基因疫苗效果的方法很多, 将具有免疫刺激和调节功能的细胞因子, 以分子内佐剂的方式与肿瘤抗原融合, 也是研究热点之一。GM-CSF是当前研究最多最具发展潜力的免疫刺激分子之一, 它能够刺激多种免疫细胞, 例如树突状细胞(dendritic cells, DC)、巨噬细胞等发育和活化, 具有重要的免疫调节功能。目前, 已经有很多学者将其以辅助分子或者分子内佐剂的方式加以应用, 都体现了其良好的抗肿瘤或者提高抑瘤效果的能力[8]。
MAGE-A3是肺癌靶向治疗中研究较多的一个靶抗原, 其在多种恶性肿瘤中高表达, 以MAGE-A3为靶点的肺癌疫苗已经分别有一项Ⅱ 期和Ⅲ 期临床试验[9]。而以MAGE-A3为靶抗原的基因疫苗也取得了较为理想的结果, 因此, MAGE-A3被看做是肺癌免疫治疗的潜在理想靶抗原之一[10]。本研究将具有重要免疫调节功能的分子GM-CSF与非小细胞肺癌高表达抗原MAGE-A3进行融合表达, 旨在通过分子内佐剂的方式来提高肿瘤抗原的免疫原性。通过ELISA和ELISPOT的方法分别检测了该重组质粒免疫实验小鼠后诱导的体液免疫反应和细胞免疫反应。结果显示, 与单独表达抗原的质粒对照组相比, 具有分子内佐剂的pVAX1- MAGE-A3-F2A-GM-CSF质粒能够诱导机体产生较强的体液免疫反应和细胞免疫反应, 这说明以GM-CSF作为分子内佐剂, 与肿瘤抗原进行融合表达的方式, 能够提高抗原诱导特异性免疫应答的能力。
综上所述, 本研究结果对于肿瘤临床治疗具有一定的提示, 对肿瘤的治疗和治愈率的提高具有指导意义, 联合治疗将成为肿瘤临床治疗的热点发展方向之一。肿瘤患者应用治疗性疫苗效果不明显的原因, 主要是因为免疫耐受和肿瘤的免疫逃逸, 而将具有抗肿瘤活性的细胞因子、免疫检查点抑制剂等, 与具有主动免疫治疗效果的免疫制剂、肿瘤疫苗进行联合治疗, 将会从很大程度上打破免疫耐受和抑制肿瘤免疫逃逸的途径。下一步, 将利用肿瘤荷瘤小鼠模型, 对该疫苗抑制肿瘤的效果进行深入研究。同时将利用其他肺癌靶抗原和成熟的佐剂分子及免疫监测点抑制剂联合应用的方式, 进一步提高和改善疫苗的效果, 以期获得一个良好的非小细胞肺癌治疗性基因疫苗候选品种。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|