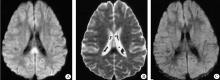
伴有胼胝体压部可逆性病灶的轻度脑炎(mild encephalitis with a reversible splenial lesion, MERS), 是近年来提出的一种新型临床影像学综合征, 多与病毒、细菌和条件致病菌感染相关。通常在发热1周或数周内出现全身乏力、精神行为障碍和癫 
2004年, Jun-Ichi等[2]第一次报道了2例伴有流感脑炎的胼胝体压部孤立性病灶, 其可逆性的临床过程和良好的预后, 显示病灶能迅速恢复正常。日本感染疾病监测中心2009-11-13报道了112例试验室确诊与流感相关的病例, 其中3例小于15岁的儿童死亡, 1例MRI表现为胼胝体压部可逆性病灶相同的图像[3]。2009年, Lister等[4]报道了英国1例儿童ICU病房的患儿, 首次描述了起源于猪的H1N1流感病毒临床表现为伴有可逆性胼胝体压部受损的短暂可逆性脑炎。基于Takanashi等[5]对54例日本患者的研究, 表明季节性流行性病毒A和B是最常见的病原体, 但确切的发病率并不清楚。
病毒引起的神经系统并发症可以为轻微的抽搐到致死性脑病, 病毒可以直接侵袭神经元, 也可以感染后引起继发性细胞因子反应。Takuji等[6]第一次报道姐妹同患该病, 提示有遗传因素参与发病的可能, 至少在一些伴有白质受损的患者中是这样。Munetsugu等 [7]报道一例8岁男孩, 腮腺炎疫苗接种后出现MERS, 表现为短暂的幻觉、颈部强直和抗利尿激素分泌异常综合征, 血清腮腺炎IgM和IgG阳性, 从脑脊液中分离出鸟居腮腺炎疫苗株。在日本153万人次接种腮腺炎疫苗后仅报道1例急性播散性脑脊髓炎, 却出现5例MERS, 提示这种腮腺炎疫苗接种后的不良事件可能比既往认识的要多。
MERS常见的病原体是流感病毒A、B(19%)和腮腺炎病毒(7%), 潜伏期2~4周, 平均18 d[8]。胼胝体是颅内最大的神经纤维束, 它不仅投射到前额叶、运动前区、初级运动区和初级感觉区, 而且投射到顶叶、颞叶和枕叶皮质。胼胝体髓鞘水肿, 造成病灶内弥散减低, 胼胝体功能受损影响大脑的运动控制、空间位置觉、视觉、听觉和语言相关的功能, 可出现构音不全和无目的运动。胼胝体后部神经纤维投射到双边视觉皮质, 胼胝体压部和周围白质病灶可以引起短暂性头痛和幻觉。一些证据提示, 流感相关性脑炎的神经症状可能与促炎性因子调节异常相关, 如白介素-6、肿瘤坏死因子-α 和可溶性的肿瘤坏死因子-1, 其中血浆白介素-6水平与临床症状及预后高度相关, 可以作为一个流感相关性脑炎的预测指标。Kawada等[9]发现, 与流感引起的发热、抽搐患者和不伴有神经系统并发症的流感患者相比, 在流感相关性脑炎中, 周围血中白介素-6和肿瘤坏死因子-α 的转录明显上调(表1)。
| 表1 流感相关性脑炎患者1例血液和脑脊液中细胞因子的动态变化(pg/ml) |
日本54个多中心的研究发现, 精神行为障碍是最常见的表现, 随后出现意识障碍和癫 

| 表2 腮腺炎5例疫苗接种后MERS临床表现 |
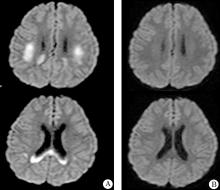
神经影像学表现为两种类型:一类是仅有胼胝体可逆性病灶, 胼胝体压部病灶对称出现, 但没有强化现象(图1); 另一类是除了胼胝体压部受损外, 病灶可以扩展到接近中央沟的皮层下白质, 可以影响到整个胼胝体, 表现为顶叶或额顶叶周围白质对称性的受损, DWI对病灶有很好的显示(图2)[12]。胼胝体仅有神经轴索和神经胶质成分, 没有神经元细胞, 神经胶质对水的吸收可以引起DWI信号强度和ADC值降低改变, 提示这个区域对细胞毒性水肿敏感, 而细胞毒性水肿提示患者有较严重的神经组织损伤。但ADC值降低也可出现在短暂的缺血、癫 
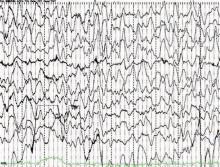
患者脑电背景活动以慢波为主, 可以记录到 
多数患者的脑脊液常规检查无异常发现。Jung 等 [14]发现, 在脑脊液和脑组织中可以检测出病毒RNA, 患者血液和脑脊液中促炎性细胞因子有升高, 而细胞因子的升高与临床症状严重程度相关。 但Kawada[9]检查了患者血和脑脊液中的炎性细胞因子水平, 结果表明血浆中白介素-6、肿瘤坏死因子-α 和可溶性的肿瘤坏死因子-1在急性期或者在恢复期没有升高, 在脑脊液中急性期仅白介素-6升高(表3)。
| 表3 腮腺炎5例疫苗接种后MERS辅助检查 |
该类疾病的疾病谱很宽, 中枢神经系统受损症状从自限性到致死性, 包括溶血性尿毒症、癫 
ADEM与MERS的关系目前尚不清楚, 患者均常有感染病史, 数周后发病, 但ADEM临床表现明显重于MERS, 通常有局灶性神经功能症状、意识障碍。MRI显示, 双侧非对称的、皮质下白质多发性长T1和长T2信号, 病灶可以强化。通常使用激素治疗有效。在急性期, 虽然急性脑脊髓炎也可以有胼胝体受损, 但患者几乎总是除了胼胝体非对称性的病灶外, 还有其他的白质病灶。
8.3 其他病因所致的胼胝体受损 一些代谢中毒性疾病和中枢神经系统感染, 甚至外伤、肿瘤及其他因素均可以引起胼胝体病变, 如军团病、低血糖、Marchiafava-Bignami综合征、营养不良、电解质平衡功能紊乱、抗癫 




胼胝体压部没有神经元存在, 轴突纤维联系多个皮质并整合皮质功能, 包括运动、认知、意识。胼胝体压部的炎性浸润和髓鞘内水肿可以引起神经系统症状急剧的改变, 降低了皮层的功能, 但是并没有引起神经元不可逆的死亡。Kashiwagi[17]报道, 患者出现致命性脑炎, 但是发现压部出现高信号者, 意识障碍恢复得较快, 与使用激素冲击治疗的患者比较, 一般非特异性治疗的患者多数预后也较好, 通常没有严重的并发症出现。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|