作者简介:王亚莉,硕士,副主任医师。
目的 观察自体骨髓间充质干细胞(human mesenchymal stem cells,hMSCs)转化神经干细胞治疗脑瘫的临床效果。方法 选择2010-06至2011-06期间, GMFCS级别III~Ⅴ级,自愿接受干细胞移植的脑瘫患儿11例为移植组,同时选择年龄、性别及疾病严重程度相仿的11例脑瘫患儿为对照组。移植组采用hMSCs转化神经干细胞移植治疗和运动功能锻炼为主的康复治疗,对照组仅仅给予运动锻炼为主的康复治疗。采用脑瘫患儿粗大运动功能评定(GMFM)量表评价移植组和对照组在治疗前和治疗后1、3、6、12、18、24个月的GMFM得分。结果 (1)移植组治疗后1个月、3个月、6个月的GMFM较GMFM0上升率均明显高于对照组( P=0.025);移植组治疗后3个月GMFM3较1个月GMFM1的上升率比较有明显差异,而治疗后6个月GMFM6较3个月GMFM3的上升率比较无统计学差异,提示移植组运动能力在移植后2~3个月时快速显示明显的康复效果。对照组GMFM上升率无此特征;(2)随访12个月、18个月及24个月发现移植组和对照组的GMFM12、GMFM18、GMFM24较之前6个月的GMFM的上升率无差异,而较治疗之前的GMFM0的上升率有显著差异( P<0.01)。(3)两组治疗后1个月、3个月的语言商与治疗前语言商比较,上升率差异均无统计学意义,两组治疗后6个月、12个月移植组语言商较治疗前上升率明显高于对照组( P<0.01)而18个月及24个月随访提示语言商上升率较对照组无增快显现,但较治疗前语言商上升率有明显差异( P<0.05)。结论 hMSCs转化神经干细胞移植治疗脑瘫安全,有效,对脑瘫患儿的运动功能改善明显,在移植后3个月明显显效。6个月以后运动康复效果逐渐消失,但患儿运动能力无倒退现象。语言功能的改善显效较晚,在移植治疗后6个月后显效,12个月后语言快速改善效果消失,但没有语言能力的倒退。
Objective To study the efficacy of autologous bone marrow mesenchymal stem cells (human mesenchymal stem cells, hMSCs) transplanted into neural stem cells for the treatment of cerebral palsy.Methods The transplantation group included 11 children with cerebral palsy; another 11 children with cerebral palsy and of the same age, gender and disease severity was as control group. The transplantation group received transplantation of autologous bone marrow mesenchymal stem cells into neural stem cells for the treatment of motor function and exercise-based rehabilitation, where as the control group were only given exercise-based rehabilitation. Both groups underwent gross motor function assessment (GMFM) before treatment and 1 month, 3 months, 6 months, 12 months, 18 months, and 24 months after treatment.Results (1) In the transplantation group 1 month, 3 months, 6 months after treatment,GMFM0 was significantly higher than that in the control group ( P<0.025). In transplantation group 3 months after therapy, the rising rate of GMFM3 over GMFM1 had significant difference; and 6 months after treatment the rising rate of GMFM3 over GMFM6 after three months had no statistically significant difference. (2) Follow-up of 12 months, 18 months and 24 months found that between the transplantation group and the control group GMFM12, GMFM18, and GMFM24 had no siqnificant difference in the rate of rise, whereas compared the GMFM the rising rate in with the six preceding months, had significant difference ( P<0.01). (3) 1 month,3 months after the treatment in the two groups, language quotients rising rate compared with pre-treatment language quotients rising rate had no significant difference. 6 months and 12 months after treatment, in transplantation group, rise rate of language quotients was significantly higher than pre-treatment ( P<0.01) and 18 months and 24-month follow-up showed that the rise rates of language guofients were not apparently faster than the control, but faster than pre-treatment with a significant difference ( P<0.05).Conclusions Transplantation of autologous bone marrow mesenchymal stem cells into neural stem cells for the treatment of children with cerebral palsy is effective and safe, markedly improves motor function, 3 months after transplantation. The exercise rehabilitation effects gradually disappear after 6 months, but the motor ability in children had no retrogradation. Marked improvement of language function is late in the 6 months after transplantation and marked rapid improvement of language disappears after 12 months, but there is no language skills setback.
小儿脑性瘫痪(简称脑瘫)是出生前到生后1个月内各种原因所导致的非进行性脑损伤, 主要表现为运动发育落后或各种运动障碍, 也可伴有智力低下、癫 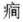
选择2010-06至2011-06, GMFCS级别Ⅲ ~Ⅴ 级, 自愿接受干细胞移植的脑瘫患儿11例为移植组, 所有患儿家长签署干细胞移植知情同意书, 该项治疗方案提请武警浙江总队医院伦理委员会和科学委员会讨论通过, 治疗过程在伦理委员会监督下完成。同时选择年龄、性别、脑瘫GMFCS评分分级相类似的常规治疗脑瘫患儿11例为对照组, 所有脑瘫患儿均根据诸福棠实用儿科学经临床确诊[5]。两组一般情况差异无统计学意义, 具有可比性(表1)。
| 表1 两组脑瘫患儿一般情况比较(n=11; \(\overline{x}\)± s) |
1.2.1 自体骨髓标本采集 移植组患儿排除严重的过敏性疾病或自身免疫性疾病, 实验室检测AIDS、肝炎、梅毒血清学标志物均阴性。骨髓采集前禁食4~6 h, 禁饮水1 h, 采集前30 min给予苯巴比妥钠5 mg/kg, 阿托品0.01 mg/kg肌内注射, 进入无菌采集室给予4 mg/kg氯胺酮肌内注射, 待患儿入睡后常规骨髓穿刺从右侧髂后上嵴采集骨髓(按照0.6~1 ml/kg体重)8~25 ml。骨髓收集管中按100 U/ml加入肝素抗凝, 骨髓采集好立刻交与细胞实验室。
1.2.2 间充质干细胞的分离与培养 采集的骨髓经过多次离心后采用全骨髓贴壁法, 骨髓样分装到多支15 ml离心管, 每管5 ml, 加入等量的PBS溶液, 配平, 离心7 min, 1000 r/min。离心结束, 小心取出, 用移液管抽取上层液体, 弃掉, 用细管抽取中间白膜层(尽量少带入红细胞), 抽到新管内, 加入PBS清洗2次后, 同上方法离心后弃去上清液, 用培养液重悬后倒入培养皿中培养间充质干细胞。置37 ℃, 5%CO饱和湿度孵箱内孵育, 48 h半量换液, 4 d后全量换液, 弃去大量的悬浮细胞, 以后每3~4 d根据培养液颜色换液。待原代细胞达到覆盖培养皿的70%~80%, 给予1∶ 2传代。
1.2.3 间充质干细胞的鉴定及使用标准 采用第2代或第3代细胞(第一次移植治疗时), 当细胞数量达到108时, 用PBS清洗2次后, 滴加0.05%的Ttypsin-EDTA液消化, 后加培养液终止消化, 制成(1~3)× 106的细胞悬液, 用流式细胞仪进行检测显示CD34阴性, CD109阴性, CD29和CD44阳性率均> 95%。移植治疗之前对细胞培养上清液进行EB病毒、巨细胞病毒、HIV病毒、乙肝病毒、支原体、细菌培养、真菌培养均阴性, 对配好的细胞悬液进行内毒素的检测。
1.2.4 自体神经干细胞诱导 取(1~3)× 107间充质干细胞加入神经诱导因子转化12 h后, 取少许转化细胞制片进行免疫组织化学染色, 显示50%~70%的细胞有巢蛋白标志物, 证实为神经干细胞, 取神经干细胞移植治疗。
患儿腰穿前同样给予禁食禁水, 苯巴比妥钠、阿托品, 氯胺酮的用法用量完全同骨髓采集前, 采用常规腰椎穿刺经蛛网膜下腔注射2~3 ml转化的神经干细胞悬液, 含神经干细胞(1~3)× 107, 同步外周静脉注射15~20 ml间充质干细胞悬液, 含间充质干细胞(1~3)× 107支持治疗。每间隔4周治疗1次, 总疗程4次。移植组同步康复治疗。
两组患儿主要观察治疗前和治疗后1、3、6、12、18、24个月的运动能力、语言能力等指标。运动能力采用脑瘫患儿粗大运动功能评定(gross motor function measure, GMFM-88)量表评价的GMFM得分, 语言能力采用GESELL量表测定得出患儿不同时期的语言商(LDQ=语言发育年龄/实际年龄), 治疗前的语言商为GESE0, 治疗后1、3、6、12、18、24个月的GESE分别记为GESE1、GESE3、GESE6、GESE12、GESE18、GESE24。同样的方法治疗前GMFM为GMFM0, 治疗后的GMFM依次为GMFM1、GMFM3、GMFM6、GMFM12、GMFM18、GMFM24, 计算出GMFM评分和GESE评分的上升率。所有评定、专人负责, 评定结果入病案文档。
采用SPSS17.0软件处理数据, 数据采用± s表示。采用成组t检验来比较两组间各项观察指标的差异, 以P< 0.05为差异有统计学意义。
两组治疗后1、3、6个月的GMFM评分均与治疗前GMFM评分比较, 移植组的GMFM较GMFM0上升率均明显高于对照组, 差异有统计学意义(P< 0.05)。移植组治疗后3个月GMFM3较1个月GMFM1的上升率比较有明显差异, 而治疗后6个月GMFM6较3个月GMFM3的上升量比较差异无统计学意义, 见表2。移植组在移植治疗之后12个月及18个月, 24个月的GMFM较治疗前的上升率均明显大于对照组(P< 0.05), 而较之前6个月比较治疗组与对照组GMFM评分的上升率差异无统计学意义, 提示移植治疗6个月之后, 移植组的运动能力快速康复效果消失, 但患儿无运动倒退现象(表2)。
| 表2 脑瘫患儿治疗后不同时间点动态粗大运动功能评定与治疗前比较(n=11; \(\overline{x}\)± s) |
两组治疗后1个月、3个月的语言商与治疗前语言商比较上升率差异均无统计学意义, 而在治疗后6个月移植组语言商的上升率明显高于对照组(P< 0.01, 表4), 提示移植治疗后语言康复效果出现较晚到移植之后6个月才明显表现。移植组在移植治疗之后12个月及18个月, 24个月的语言发育评分较治疗前的上升率均明显大于对照组, 差异有统计学意义(P< 0.05), 治疗后12个月同治疗后6个月比较仍然提示治疗组的语言快速康复(P< 0.05, 表4), 治疗后18个月及24个月两组比较移植组语言快速康复的效果消失, 但没有倒退现象。
| 表3 两组脑瘫患儿治疗后不同时间点的语言商评定比较(n=11; \(\overline{x}\)± s) |
移植组没有出现发热、呕吐等反应, 1例移植后哭闹频次明显增多, 未给予特殊处理, 2 d后自行缓解。
1998年, 我国六省市调查1~6岁小儿中脑瘫患病率为1.92‰ [3] 。由于围产急救医学的发展, 使新生儿死亡率降低, 但缺氧缺血性脑病和早产儿的脑瘫发病率却有逐年上升的趋势。资料显示在美国学龄儿童脑瘫的患病率为3‰ ~4‰ [4]。缺氧缺血性脑病、早产是脑瘫的常见原因[5], 运动发育落后及异常是脑瘫患儿最显著的特点。脑瘫患儿头颅磁共振的表现大多为脑室周围脑白质损伤(periventricular white matter damage, PWMI), 病理改变包括脑室周围白质软化和弥散性髓鞘形成障碍[6]。本研究11例中头颅磁共振检查提示脑白质病变者6例, 占54.5%, 与印度学者报道, 102例1~3岁的脑瘫患儿中有47.1%头颅磁共振提示存在PWMI[7], 基本相符。
脑瘫传统的治疗包括理疗、运动功能锻炼、语言训练、外科矫形、手术神经切断术, 以及肌内注射A型肉毒毒素缓解痉挛等治疗均属于对症治疗, 没有从根本上改善脑瘫患儿大脑内部的病变[1]。由于间充质干细胞具有良好的组织修复和免疫调节功能, 国内外已有关于hMSCs移植治疗脑瘫的实验报道, 并可以通过顺磁性氧化铁粒子(MPIO)标记间hMSCs后给脑损伤的动物移植, 脑室注射后第2天头颅MRI即可显示MPIO标记的间充质干细胞向病变部位出现, 而静脉注射后1周可检测到移植的间充质干细胞迁移到病变部位, 移植后120 d, 病理检查发现不到10%的hMSCs分化为神经元和胶质细胞, 而且病灶中心形态测量, 发现动物脑白质量有增加。以上实验充分证明, hMSCs移植治疗脑瘫的可行性, 同时也提示间充质干细胞移植治疗脑损伤不仅仅是可以转化为神经元和神经胶质细胞, 更重要的是可以产生并通过旁分泌的形式释放多种细胞因子, 促进损伤区域的修复[8, 9]。至今国内干细胞移植治疗脑瘫已经报道很多, 移植细胞有胚胎神经干细胞、异体胚嗅鞘细胞、脐带间充质干细胞、hMSCs 4种[2, 3, 10, 11]。主要移植途径是腰椎管和脑室注射。由于异体胎脑NSCs来源和取材均困难, 还存在伦理问题, 另外从脑内移植危险性比较大, 难以反复移植; 而经腰椎管移植和脑内移植途径效果类似, 而且可以反复移植增加治疗效果。神经干细胞移植治疗脑瘫、以及各种脑及脊髓损伤的实验已经证实移植的神经干细胞具有很强的自我增殖能力, 移植后与宿主细胞发生神经整合, 建立稳定的突触联系, 成为有功能的替代神经细胞[12]。间充质干细胞移植可促进血管的形成并能产生大量的细胞因子在脑损伤局部, 如血管内皮生长因子(VEGF)、神经营养因子等[13, 14, 15], 这些细胞因子可以增强移植的神经干细胞的活力, 因此, 笔者采用神经干细胞腰椎管注射和间充质干细胞外周静脉注射联合促进病变部位的修复。
本研究11例为临床配对研究, 应用自体BMSC体外转化为NSCs, 反复经腰椎管移植治疗3~4次, 辅助周围静脉移植自体间充质干细胞; 移植组和对照组均同步康复综合治疗, 观察24个月, 本研究结果显示, 移植组治疗后1、3、6个月的GMFM1, 3, 6较GMFM0上升率均明显高于对照组, 表明移植组运动能力康复较对照组者明显快, 为干细胞治疗脑瘫的效果提供更有力的临床证据; 同时发现移植治疗3个月后运动功能进展不如前3个月明显。发现移植组在移植治疗之后12个月及18、24个月的GMFM较治疗前的上升率均明显大于对照组, 而较之前6个月比较治疗组与对照组GMFM评分的上升率差异无统计学意义, 提示移植治疗12个月之后, 移植组的运动能力快速康复效果消失, 但患儿无运动倒退现象。而移植组患儿的语言快速康复效果在移植治疗后6个月明显表现, 到12个月仍显示较对照组语言康复快速, 而到移植治疗18个月后语言的快速康复效果消失, 但没有语言倒退现象, 语言的康复表现在说话声音较前洪亮, 吐字较前清楚, 自主语言较治疗前增加, 正确回答问题能力增加。提示患儿的思维能力有改善。提示神经干细胞治疗对患儿的智力改善有帮助。
本研究比较系统观察自体BMSC体外转化为NSCs腰椎管移植治疗脑瘫的临床效果, 显示对脑瘫患儿的运动康复效果明显提速。脑瘫就是以中枢运动障碍为主疾病, 当患儿能够快速运动康复, 必然提高康复效果; 由于腰椎管移植和脑内移植途径效果类似, 故采用腰椎管移植hMSCs转化的神经干细胞, 也避免选择异体胚转化NSCs或异体胚嗅鞘细胞移植的烦恼; 同时外周静脉同步注射间充质干细胞, 既发挥免疫调理作用, 又辅助修复脑损伤的作用。脑瘫患儿语言障碍是由于脑损伤而引起的构音器官运动障碍而导致的发音和构音不清及语言发育迟缓, 因语言康复受综合因素影响[16], 同时本研究患儿细胞移植治疗之后未进行专业的语言训练。语言训练在语言的康复过程中也起重要作用, 在7~24个月时期是小儿脑语言信息通路建立最关键时期[17, 18], 本研究显示语言的改善较运动康复效果要滞后, 但也显示了很好的语言康复效果, 因为语言需要口腔、面部以及咽喉部肌肉协调运动才能良好的构音、吐字、讲话, 只有相关肌肉的力量及协调性好了以后才能显示语言的改善, 这可能是治疗后语言改善滞后的原因。
综上所述, 对脑瘫患儿越早康复效果越好是公认的理论, 对中重症脑瘫患儿, 仅依靠常规综合康复方法效果有限, 如果越早给予干细胞移植, 再加上常规综合康复方法, 可明显加快运动能力和语言能力的康复, 避免错过小儿早期脑细胞突触建立的关键时期, 为促进脑瘫获的理想整体康复效果提供重要的治疗方法, hMSCs转化神经干细胞移植治疗脑瘫取得了好运动及语言的康复效果, 但最终是神经元的替代还是细胞破裂后释放大量的细胞因子的作用, 仍然需要进一步研究。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|


