目的 探讨经骨髓间充质干细胞诱导分化的神经样细胞对大鼠脊髓损伤的修复作用。方法 提取、培养和扩增骨髓间充质干细胞后,在体外诱导分化为神经样细胞。大鼠脊髓损伤造模后,分别进行神经样细胞、骨髓间充质干细胞及无细胞悬液移植,每组18只。术后采用BBB评分及斜板实验观察3组大鼠的运动功能恢复情况。结果 体外诱导骨髓间充质干细胞后,经免疫组化染色发现具备神经细胞特征。术后6周,BBB评分方面,实验组(16.56±2.42)优于阳性对照组(13.70±2.66),后者又优于阴性对照组(8.37±2.35)。Rivlin斜板实验评分方面,实验组术后2、4、6周,均优于阳性对照组,后者又均优于阴性对照组。实验组术后可见较多的神经纤维,结构完整,优于阳性对照组及阴性对照组。结论 体外诱导骨髓间充质干细胞向神经样细胞分化后,移植治疗大鼠脊髓损伤具有良好效果。
Objective To study transplantation of bone mesenchymal stem cells (BMSCs) derived neuron-like cells for repairing the rat spinal cord injury.Methods BMSCs were isolated from the femur of 4-week-old Sprague-Dawley rats, after culture and proliferation, then differentiated into neuron-like cells induced by retinoic acid (RA). After spinal cord injury (SCI) model preparation, forty-eight rats were randomly assigned to the following three groups ( n=18): the neuron-like cells group, the BMSCs group and the control group. The rats’ motor functional recovery was evaluated by BBB score and Rivlin platform test at 2 w, 4 w, 6 w after operation.Results The neuron-like cells derived from BMSCs had some neurocyte characteristics. Transplantation of neuron-like cells(16.56±2.42) showed higher score than BMSCs(13.70±2.66). The rat functional recovery in the neuron-like cells group and the BMSCs group was better than in the control group. There was more nerve fibers with normal structure could be observed in the neuron-like cells group.Conclusions Transplantation of neuron-like cells derived from BMSCs for treating rat spinal cord injury is a promising treatment.
脊髓损伤的治疗是一个难点, 目前越来越多的学者研究应用干细胞治疗脊髓损伤[1, 2], 其中以骨髓间充质干细胞(bone marrow stromal cells, BMSCs)应用最为广泛。BMSCs具备多向分化能力, 可以分泌神经营养因子, 促进髓鞘形成, 维持神经元的存活[3]。之前亦有很多研究证实BMSCs移植治疗大鼠脊髓损伤的作用[1, 2]。随着研究深入, 学者们发现单纯BMSCs移植对脊髓损伤的修复并不理想, 存在诸多问题, 如向神经元分化率低, 甚至形成瘢痕组织影响功能恢复[4]。本研究中, 笔者在体外将BMSCs向神经元方向分化, 然后移植入大鼠脊髓损伤处, 以提高BMSCs对脊髓损伤的修复作用。
取SD大鼠1只(出生4周左右, 雌雄不限, 体重150 g, 东南大学动物医学中心), 以2%戊二醛腹腔注射麻醉后, 75%乙醇浸泡3 min后, 从大鼠股骨下端抽取骨髓, 将骨髓与含10%FBS的MEM全培养液以1∶ 8的体积比例混匀, 接种于50 ml培养瓶, 于标准(5%CO2、37 ℃)培养条件下培养, 2 d后首次换液, 以后每3~4 d换液1次。待培养至第12~14天, 细胞覆盖瓶底面积达80%左右, 用0.1%胰蛋白酶和0.02%的EDTA于标准培养条件下消化5 min, 按照1∶ 3的比例传代培养, 以后待细胞基本长满, 按上述方法消化传代, 再纯化并扩增BMSCs。
取P3的BMSCs, 吸除培养液后, 加入200 μ l的RA(维甲酸)诱导液(Sigma公司, 美国), 放入培养箱中。24 h后在倒置显微镜下观察对照组细胞形态变化, 每隔3 d换一次液。加入RA诱导液后第6天, 进行MAP-2抗体的免疫荧光染色, 观察神经样细胞的生成情况。将培养液倒出后, 用PBS冲洗1次去除残留的溶液。后加入事先配制好的固定液1(2%tritonX-100, 0.5%甲醛-PBS溶液)1 ml浸泡5 min, PBS冲洗一次, 加入固定液2(4%甲醛-PBS溶液)1 ml浸泡20 min。PBS冲洗3遍后去除残留溶液, 加入1%BSA-PBS, 置于37 ℃恒温箱中封闭1 h。取出后滴加1∶ 200一抗兔抗大鼠MAP2-IgG(Sigma公司, 美国), 置于4 ℃冰箱中过夜。取出样品, 用PBS漂洗后, 加入1∶ 200的ALexa-Fluor 488标记的羊抗兔二抗(Sigma公司, 美国), 在避光条件下置于37 ℃恒温箱中孵育1 h。PBS漂洗后以Hoechst 33342(5 mg/ml)染细胞核, 室温下避光孵育30 min。最后用PBS漂洗后封片置于激光共聚焦显微镜下观察。
成年SD大鼠54只, 体质量200~250 g, 雌雄不限, 随机分为3组:BMSCs向神经样细胞分化后移植组18只(实验组), BMSCs移植组18只(阳性对照组), 对照组18只(阴性对照组)。大鼠以2%戊巴比妥钠(2 ml/kg)腹腔麻醉后, 俯卧位固定于手术台上, 取后正中切口, 逐层显露T8至T10椎板, 行全椎板切除, 暴露出硬脊膜, 采用改良的Allen重物打击法[5], 在硬脊膜表面放置一个直径约3.0 mm的圆形垫片, 用重10 g的铜制重物沿玻璃导管从25 mm高处垂直自由下落击打在垫片上, 造成脊髓损伤。打击后大鼠出现摆尾反射, 双下肢及躯体回缩样扑动, 麻醉清醒后双下肢弛缓性瘫痪为造模成功。实验组在造模后在损伤部位周围, 以5 μ l注射器穿刺入硬脊膜, 向脊髓组织内注射5 μ l的神经样细胞悬液, 密度约105/μ l, 阳性对照组注射密度约105/μ l, 5 μ l的BMSCs的悬液, 阴性对照组注射5 μ l的培养液。逐层缝合切口。术后予以大鼠5万U青霉素肌内注射预防感染, 1次/d, 连续3 d, 注意保暖, 分笼饲养, 每天2次行膀胱按摩协助排尿直至建立反射性排尿。
于术后2、4、6周对大鼠进行BBB功能评分[6], 由非本组实验人员但熟悉评分标准者完成。同期行Rivlin斜板实验[7], 将大鼠长轴与斜板纵轴呈垂直, 斜板角度每升高5° , 以大鼠停留5 s的最大角度为其功能值, 重复3次, 取平均值。
术后6周实验组、阳性对照组、阴性对照组处死大鼠后, 取T8至T10的脊髓组织, 4%多聚甲醛溶液固定后组织横向石蜡切片, 片厚5 μ m。常规HE染色后, 高倍镜下观察。
采用SPSS17.0软件进行处理, 计量资料以± s表示, 组间均数比较采用方差分析, 进一步两两比较采用q检验, P< 0.05为差异有统计学意义。
刚接种的干细胞形态呈圆形, 悬浮状态, 混有少量血细胞, 24 h后可见细胞贴壁, 10 d后细胞为典型的梭形, 核仁清楚, 数目增多, 长满瓶底, 80%左右已融合, 即可进行传代(图1)。
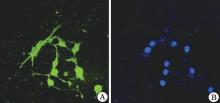
P3的干细胞培养瓶中加入诱导剂后, 24 h后观察, 可见部分细胞胞体开始回缩变小, 边缘变得不规整, 突起逐渐伸出, 呈不规则或圆形, 周边折光性强。随着时间的延长, 回缩的细胞越来越多, 突起越来越长; 第9天时镜下可见两种具备神经细胞形态特点的细胞, 类似多极或双极细胞(图2)。加入诱导液后的第6天, 可见MAP-2抗体免疫荧光阳性的细胞(图3)。
BBB评分见表1, 术后2周, 各组之间比较未见明显差异, 术后4周和6周, 实验组优于阳性对照组, 均优于阴性对照组。Rivlin斜板实验评分同BBB评分类似, 术后2、4、6周, 实验组优于阳性对照组, 阳性对照组优于阴性对照组(表1)。
| 表1 大鼠术前及术后BBB评分和Rivlin斜板实验评分(n=18; \(\overline{x}\)± s) |
在脊髓损伤治疗中, 不同种类的干细胞已经被尝试应用, 并被评价其疗效, 其中BMSCs是被研究最多的, 因为BMSCs易于采集和培养, 且可以结合在宿主脊髓损伤区域、桥接中断的神经组织、分泌多种神经营养因子[8], 以及有分化为多种神经细胞的能力[9]。但是, 脊髓损伤部位微环境的改变、各种炎性因子的存在, 以及局部瘢痕组织的形成, 对于移植的干细胞存在不利的影响[10], BMSCs还有可能分化为成纤维细胞或者星形胶质细胞, 甚至肿瘤细胞, 但向神经方向分化的效率不高[11], 不利于脊髓损伤的修复。笔者发现本研究单纯移植BMSCs在大鼠脊髓损伤处的修复作用有限, 对功能恢复并不理想。为了提高对于脊髓损伤的修复效果, 有不少学者将BMSCs联合其他细胞或生物材料进行移植[10]; 也有学者对干细胞进行转基因修饰, 使其高表达各种利于脊髓损伤修复的细胞因子, 如NT-3等[8]。
本研究中, 笔者通过体外对干细胞的诱导, 使其向神经细胞方向分化, 后移植入脊髓损伤区域, 发现诱导干细胞向神经方向分化后, 再移植, 其修复损伤效果要优于BMSCs直接移植。笔者认为, 其原因在于经过体外的诱导分化后, 干细胞向神经分化的能力或效率要好于干细胞在体内向神经方向的分化。
在体外诱导BMSCs向神经方向的分化上, 目前主要诱导方式有化学因子诱导、细胞因子诱导, 以及物理因素诱导等[12], 化学因子包括维A酸、二甲基亚砜等。有学者发现, RA主要通过上调转录因子神经元D, 使神经生长因子受体酪氨酸激酶TrkA、TrkB、TrkC和p21表达增加, 使MSCs向神经元方向分化[13]。有研究发现, 利用RA和bFGF联合诱导12 d后, MSCs不仅表达Nestin、MAP2等神经标志物, 且表达神经转运受体GABA-A, 具有突触后动作电位[14]。有研究者将纳米定向纤维与RA相结合时可诱导MSCs表达神经元标志物MAP2、少突胶质细胞标记物GalC和RIP、星形细胞标记物GFAP[15]。本研究中笔者也采取维A酸诱导BMSCs向神经方向分化, 发现它具备良好的诱导作用。
干细胞向神经元方向的分化机制目前尚不清楚, 可能是多种机制共同作用导致BMSCs的基因表达改变, 激活了神经外胚层的基因表达, 从而导致BMSCs向神经元方向分化[16]。近年来, 有研究发现, Wnt/β -catenin通路可能在BMSCs向神经方向分化过程中发挥调控作用[17]。
本研究发现, BMSCs体外诱导为神经样细胞后再移植治疗大鼠脊髓损伤, 比单纯BMSCs移植更具优势, 但是其修复机制及在体内的转归需要进一步深入研究。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|