作者简介:韩鸿宾,博士导师,主任医师。
脑内因缺少淋巴系统, 其组织液的引流依靠细胞间隙内物质转运来实现, 这是维系脑微环境稳态的保证。以往脑细胞间隙(extracellular space, ECS)的测量主要依赖电化学法、光学示踪法。由于两类方法只能显示脑浅表区域或者两点间距离小于200 μ m的细胞间隙结构或功能信息, 因此脑深部广阔区域组织通道与细胞间隙的结构与功能尚未知。为了研究脑深部广阔区域细胞间隙结构及其内物质转运的规律, 笔者研究团队发明了一种新型磁示踪成像方法, 成功成像显示了脑深部组织液的引流, 并可同步获取纳米级的细胞间隙结构的特征性参数指标。由于新发明的磁示踪法在探测深度等技术性能指标方面的进步, 笔者研究团队发现了脑组织液(interstitial fluid, ISF)引流系统内存在屏障结构, 并因屏障结构的存在而发现脑内新的解剖学分区系统, 即ISF引流分区系统。还使用光学显微镜和磁共振张量成像技术, 确定了组织液引流屏障为穿行于组织间的致密排列的髓鞘纤维束。因此, 笔者提出脑分区稳态假说。由此认为, 脑器官除拥有血脑屏障对由循环系统而来的潜在危害进行屏障保护外, 在脑内也存在组织液引流的分区屏障, 从而可维系脑内不同分区的稳态。以此为基础与起点, 脑科学与脑病治疗有望进入一个全新的发展阶段。
百十年来, 基于细胞学说的脑科学一直围绕“ 神经元学说” 展开系列研究, 在脑细胞的认识上学术成绩斐然。然而, 从临床角度来看, 脑病治疗没有取得实质性的突破和进展, 卒中、阿尔兹海默病等依旧摧残着人类的健康与尊严; 认知、记忆依然是未解之谜[1]。回顾历史, 究其原因, 可以发现脑科学研究体系尚存解剖结构和认识的盲区:脑细胞微环境。
脑细胞微环境, 也称ECS, 或称脑组织通道, 是直径为20~60 nm的微观结构, 其占据活体脑容积的15%~20%, 是维系脑细胞生存内环境稳态结构的基本功能单元。现有关于活体细胞间隙的知识基本来源于美国纽约大学Charles Nicholson教授在20世纪90年代发明的两类测量方法:电化学法与光学示踪法[2]。由于原理和技术性能的限制, 上述方法只能采集到组织浅表(约200 μ m)或小范围(50~200 μ m)的ECS信息。近来, 随着精准医学、组织工程、干细胞移植、认知、睡眠等新兴学科的快速发展, 现有ECS测量方法已无法满足上述前沿领域的研究需求, 对生物体深部广阔未知区域ECS的信息获取、处理分析与成像显示已成为亟需解决的关键性技术瓶颈与难题[3]。同时, 也因为以往探测手段的技术限度, ECS在认知及脑病发生发展中的作用与机制远未被充分认识和阐明。这种认识的局限性已经直接或间接导致了全世界耗资数千亿美元、经传统血管途径的脑病药物研发项目面临整体失败[4]。20世纪末, 美军方开始探索经ECS途径给药以突破血脑屏障对药物入脑的限制[5]。然而, 正是因为对脑微环境结构信息认识的不足, 通过ECS途径将药物导入脑内后, 药物分布、清除等关键指标均无法精准计算。
上述生命科学前沿领域、脑研究与新型脑病药物治疗领域所存在的诸多难题与困境的源头, 均指向了以往ECS微观结构测量方法的技术局限性, 开发可探及脑深部广阔区域细胞间隙的新型定量分析方法成为必要。
为获取生物体深部广阔区域细胞微环境的结构与功能信息, 笔者从2003年开始对上述测量技术的限度进行系统研究, 提出了基于磁标记示踪原理的新型测量方法。经过十多年潜心研究, 建立了细胞间隙磁示踪成像分析法, 成功采集到深部组织细胞间隙信号, 并实现了结构与功能参数信息的同步分析与成像显示, 该方法于2013年获国家发明专利(ZL 200980126605.2)。磁示踪法以磁共振成像仪(magnetic resonance imaging, MRI)为信号采集平台, 采用镧系金属离子螯合物及其衍生物作为分子探针, 对细胞间隙内水分子进行特异性的标记, 从而实现ECS的信号采集、信息处理分析与成像显示[6]。具体而言, 在高磁场环境下, 导入到ECS内的Gd离子可作用于距离其2.41~2.44 Å 的水分子中的氢原子核, 加快氢核的进动频率, 缩短其纵向弛豫时间, 使其在磁体环境下被“ 激活” , 在MRI图像上表现为高信号。采用调整射频激发角的快速小角度激发序列实现了像素内探针浓度的实时定量分析。在此基础上, 利用对流扩散方程对细胞间隙微观结构特征信息进行解析求解, 最终可同步获得细胞间隙结构与功能特征参数。应用图像配准与矫正技术, 可对细胞间隙内组织液在全脑范围内的动态分布与清除过程进行动态观察与成像显示[7](图1)。
正是由于磁示踪法在原理与技术性能指标上的进步, 使得对脑内组织间隙这一未知结构有了新的认识上的突破:(1)发现脑内存在新的分区系统, 如ISF引流分区系统; (2)发现调控不同脑区内组织液流速的方法; (3)阐明脑内分区系统产生机制; (4)提出脑分区稳态学说为切入点的细胞微环境学说。
应用磁示踪法, 笔者发现大鼠脑内存在不同的组织间隙分区系统。尽管尾状核与丘脑彼此邻近, 但其内部的细胞间隙内组织液无法在两个脑区内相互沟通, 并且丘脑和尾状核两个脑区内组织液的流动速度、分布范围, 以及其内部细胞间隙的微观结构特征均不相同[7]。换言之, 笔者发现了脑内可阻止ISF流动和其内物质转运的屏障结构(图2)。
细胞微环境是脑细胞生存的直接环境, 因此, 细胞微环境不仅对细胞活动、代谢起到支持作用, 也将随着脑细胞兴奋活动而发生变化, 并需要在一定时间内恢复原有状态, 以保持局部稳态, 并为一下次的神经兴奋活动提供基础条件。由于以往技术的限度, 神经兴奋与ISF流动的关系一直是迷。近来, 笔者应用磁示踪法, 利用大鼠电刺激模型激活丘脑区神经元兴奋, 观察到丘脑区内组织液随神经元兴奋发生了延迟的流速下降, 该流速的下降持续数小时, 且不伴有局部间隙结构的改变。这种神经兴奋导致的局部组织液流速下降不仅可解释脑疲劳与睡眠, 并且也为药物在脑内分布、代谢与清除过程提供了一种完全无创的调控手段, 对于脑病药学研究以及经脑间质途径的局部给药脑病治疗具有重要价值[8]。
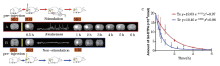
Ts为丘脑3 mA电流刺激组; Tc组为丘脑无痛觉刺激组。A行显示Ts组示踪剂清除减慢过程, 其完全清除需要6 h, 半衰期为(1.49± 0.13) h。B行显示Tc组ECS内物质转运比Ts组迅速, 示踪剂完全清除仅需3 h, 半衰期为(0.81± 0.03) h。图表C红色及蓝色曲线分别显示Ts和Tc组示踪剂浓度单指数衰减过程。
对于继发于体表刺激的丘脑区组织液流动速度调控, 笔者提出了两个可能的机制:一是生物化学机制, 即神经兴奋伴随着一系列化学活动, 离子交换, 神经递质释放, 改变了局部的电位, 影响负载电荷的分子探针在ECS内的运动速度改变[9]; 二是生物力学机制, 即神经兴奋可导致星形细胞的暂时性肿胀, ECS容积下降高达30%。丘脑区胶质细胞的数量远远大于神经元, 肿胀细胞导致局部ECS的变形, 并阻碍分子探针的运动。
ECS中的物质转运和ISF流动是一个非常复杂的过程, 由ECS的几何机构和ISF中物质的扩散特性所决定。细胞膜和细胞外基质构成了脑ISF流体场的边界状态。因为脑内不存在淋巴系统, 神经元、星形细胞等细胞膜与细胞外基质均直接暴露于细胞间隙或组织通道内[10]。同样, 由少突胶质的细胞膜或髓鞘也直接暴露在ECS空间内, 形成了ECS的边界, 尤其在白质区。对ISF流动起到完全阻挡作用的是纤维束高度密集的区域, 比如尾状核与丘脑之间的内囊, 而在相对疏松的纤维束内, 如放射冠区域, 物质可以自由转运。因此, 脑ECS中的物质转运不仅仅由局部ECS迂曲度决定, 也由穿行髓鞘纤维的走行、完整性和致密性决定。更重要的是, 笔者发现, 皮质内组织液也部分来源于脑深部。
同时, 笔者还发现, 髓鞘纤维的走形和分布不能解释所有的脑ECS分区。嗅叶、下丘脑等分区与邻近脑组织之间没有明显的髓鞘纤维束分隔, 其大面积暴露于脑脊液(cerebro-spinal fluid, CSF)中, 导致ISF与CSF之间高效的物质交换和这个脑区中示踪剂的快速清除, 由此导致功能分区或单位的形成。因此, 脑ECS分区形成的机制可能是复杂不同的。进一步探索机制应充分考虑ECS内扩散特性, ISF引流途径, 每个分区内以及周围的纤维束等。
髓鞘在脑生长、成熟和衰老的整个生命进程中不断变化, 这种变化与脑ECS的几何结构及ISF流动均有关。作为脑ECS的边界和引导ISF流动, 髓鞘纤维束也与神经元迁移、星形细胞瘤的播散、神经元分化、突触形成、大脑退化过程、组成和重组有关。髓鞘纤维束作为脑内转运屏障的新功能, 为理解脱髓鞘疾病及伴随髓鞘完整性脱失的其他疾病(如精神分裂症)的病理提供了全新视角[11]。髓鞘形成损伤不仅可以降低轴突传导及神经元间信息交互的效率, 还破坏脑ISF的引流和局部脑稳态。进一步的研究应当说明髓鞘脱失可在多大程度上损伤局部脑稳态, 以及产生影响的确切关系和这些疾病最终的症状。转运分区被发现和区域性脑稳态的假说可能给当前脑结构、功能、发育、衰老、脑疾病和脑病的治疗方法的理解带来巨大的冲击。
本研究发现的ISF流动的位置依赖特性对脑病外科手术, 乃至中枢神经系统(central nervous system, CNS)新药研发都将产生深远影响。过去几十年中, 以西方药厂为主力的各类脑病药物研发面临整体失败。磁示踪法对全ISF引流的认识进步将为这些宣布失败的药物的复活带来希望。
尽管血管仅占全脑容积的3%~5%, 几乎所有以往的药物研发和临床试验均将其作为治疗脑病的唯一路径[12]。治疗脑缺血性中风的神经保护药物是上述失败中的典型代表:通过传统的口服或静脉内注射途径, 神经保护药物要到已经完全没有缺血没有血供, 或者已经持续一定时间低灌注的缺血区域, 且由于血脑屏障的存在, 药物的通过效率本身就很低。即使部分药物通过血脑屏障, 药物也要经过在脑ECS内转运的过程, 才能由血管床到达受损的神经细胞。比较而言, ECS占全脑容积的15%~20%。即使是在缺血性损伤导致细胞毒水肿的情况下, 体积缩小的ECS仍占全脑容积的3%~5%, 仍与正常脑内血管所占的容积相当[2]。与常规经血液途径的药物治疗, 经脑ECS的脑局部直接给药拥有诸多优势, 比如绕过血脑屏障、低毒性、高效等。根据我们目前的研究结果, 任何CNS药物的研究和开发应考虑到脑ECS分区, 因为药物的分布和清除过程取决于不同分区。在脑局部给药时, 也需要考虑从导入点到靶区共有多少分区的存在。
根据上述原理, 基于鼠脑内大脑中动脉供血区域内的ECS分区的定量分析, 笔者建立一种经ECS途径的脑病治疗新方法“ 简单扩散给药法” [13], 较美军所拥有专利技术的“ 对流增强给药法” 更加高效、低毒且无创。在2011年, 笔者已经证实通过脑ECS给予很少剂量的胞磷胆碱即可防止神经元缺血性损伤[14], 而传统给药途径已经宣布了这一药物无效。此外, 如前述及, 我们最近证实了丘脑的物质转运可由体表疼痛刺激后通过局部神经元兴奋进行调节[8], 这一发现有望使药物在脑内的分布得以安全控制。
总之, 笔者研究团队在过去的十年中, 发明了可探及脑深部组织细胞间隙和组织液引流的磁示踪法, 借此技术的先进性, 发现了脑ECS内存在组织液引流的分区系统, 从而提出脑分区稳态的假说。这些均有助于引起人们对内环境的重视, 细胞学说需要细胞微环境学说作为补充, 同等重视脑细胞微环境的脑科学将有望由此进入新的发展阶段。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|