作者简介:吴 梅,硕士,主治医师。
目的 评价表观弥散系数(apparent diffusion coefficient,ADC)在不同组织来源的肝脏转移瘤的诊断价值。方法 回顾性分析45例经1.5T MRI检查的肝脏转移瘤患者的扩散加权图像,采用单因素方差分析276处肝脏转移瘤的ADC值,比较不同肿瘤组间的差异性。结果 来源于胃直肠癌、肝癌、乳腺癌的肝脏转移瘤的平均ADC值间的差异无统计学意义。来源于肺癌的肝脏转移瘤的平均ADC值低于其他来源的肝脏转移瘤,差异有统计学意义( P<0.05)。来源于胰腺癌的肝脏转移瘤的平均ADC值高于其他来源的肝脏转移瘤,差异有统计学意义( P<0.05)。结论 ADC值在肺癌和胰腺癌来源的肝脏转移瘤的诊断中有一定的价值。
Objective To evaluate apparent diffusion coefficient values in the diagnosis of liver metastases from different primary tumors.Methods Diffusion-weighted imaging in 45 patients after 1.5T MRI examination was retrospectively analysized. The ADC values of 276 liver metastases were measured and performed with one-way ANOVA to compare the difference in different primary tumors.Results No significant difference in ADC values were found between gastrointestinal malignant tumor, liver cancer and breast cancer ( P>0.05).The ADC mean values in lung cancer were lower than in other primary tumors with statistically significant difference ( P<0.05). Those values in pancreatic carcinoma were significantly higher than in other primary tumors ( P<0.05).Conclusions The ADC values are helpful to diagnosis of liver metastases from lung cancer and pancreatic carcinoma.
随着MRI软、硬件技术的不断发展, 扩散加权成像(diffusion-weighted imaging, DWI)已在腹部得到较为广泛的应用。DWI可以通过检测组织内水分子的运动状态来间接反映组织的结构特点, 不同组织的病变可能有不同的组织结构特点, DWI可以从微观水平为病变的鉴别诊断提供相关信息。本研究通过分析肝脏转移瘤的DWI, 测量其ADC值, 探讨不同组织来源的肝脏转移瘤的ADC值的诊断价值。
选取2014-01至2015-10行MRI检查的肝脏转移瘤患者, 所有患者均行常规序列及DWI序列扫描, 排除因伪影(呼吸伪影、胃肠道蠕动伪影、肠气等所致磁敏感伪影)或因病灶太小无法准确测量ADC值的病灶[1], 共计45例肝脏转移瘤患者被纳入本研究中(组织来源分别为胃肠道恶性肿瘤、乳腺癌、肺癌、肝癌和胰腺癌; 其他来源的肝脏转移瘤因病灶数较少无法进行分组分析, 未被选入)。其中男21例, 女24例, 年龄38~92岁, 平均为(59.76± 12.66)岁。所有病例均有明确的原发病灶, 原发肿瘤组织病理学均由活检或手术获得。45例患者的原发肿瘤分别为乳腺癌14例(31.1%), 胃肠道恶性肿瘤10例(22.2%), 4例胃癌, 6例直肠癌, 肺癌10例(22.2%), 其中小细胞肺癌7例, 腺癌2例, 鳞癌1例; 胰腺癌6例(13.3%), 肝癌5例(11.1%)。
45例肝脏转移瘤患者中共计有276处转移灶被纳入本研究中, 肝脏转移瘤的病灶直径6~85 mm, 平均为(30.06± 12.82) mm。肝脏内的转移病灶均有典型的影像学表现及前后影像对照或复查结果及临床资料支持。
所有患者均使用1.5T超导核磁共振机(德国西门子, MAGNETOM Avanto) 进行扫描, 并采用体部表面相控阵线圈。均选用以下扫描序列:定位扫描、冠状T2WI、常规轴位T2WI及T2WI压脂、常规轴位T1WI同反相位、动态增强三维容积GRE T1WI压脂序列; DWI扫描采用自由呼吸单次激发平面回波序列。DWI序列扫描参数:TR 5400 ms, TE 104 ms, FOV 380 mm, 层厚 6 mm, b值取0及800 s/mm2。ADC值图像由系统软件自动生成。增强扫描静脉注射使用钆喷酸葡胺注射液(北京北陆药业股份有限公司), 注射剂量为0.15 ml/kg。
肝脏内转移瘤病灶ADC值的测量方法如下:取不规则形感兴趣区(ROI)覆盖病灶的实质部分, 避开病灶的囊变、坏死区域, 每个病灶测量3次, 取其平均值; 测量较大病灶时取病灶最大的3个层面分别测量, 取其平均值; 为避免测量误差, 尽量避开胆道、血管及伪影。
参照文献[2], 本研究中将所评价的ADC值(× 10-3 mm2/s)分为:(1)非常低值, < 0.70; (2)低值, 0.70~0.90; (3)中等值, 0.90~1.20; (4)高值, > 1.20。
所得数据通过描述性统计来分析, 分类变量频数使用百分比来描述。采用SPSS18.0统计软件, 用单因素方差分析处理所得的肝脏转移瘤的ADC值, 比较不同组织来源的肝脏转移瘤间的差异性, 不同肿瘤组间应用Bonferroni校正, P< 0.05为差异有统计学意义。
276处肝脏内转移灶中, 79处(28.6%)病灶来自于胃直肠癌患者, 63处(22.8%)来自肺癌(其中小细胞肺癌53处, 占肺癌总数的84.1%; 非小细胞肺癌10处), 59处(21.4%)来自胰腺癌, 48处(17.4%)来自肝癌, 27处(9.8%)来自乳腺癌。6例病例有一处转移灶或一处有效转移灶(其余病灶为弥漫小病灶或无法准确测量ADC值), 39例有两处或两处以上的转移灶, 范围1~29处, 平均转移灶数为(5.5± 4.1)处。
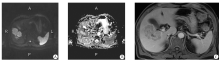
276处肝脏转移瘤的平均ADC值为(1.08± 0.24)× 10-3 mm2/s, 取值范围为(0.41~1.94)× 10-3 mm2/s(图1)。不同组织来源的肝脏转移瘤平均ADC值的分布结果见表1。
| 表1 不同组织来源的肝脏转移瘤的平均ADC值的分布(n; %) |
本研究中肝转移瘤的平均ADC值的取值范围较广泛, 大部分以中等值为主。同时, 不同组织来源间的肝内转移瘤平均ADC值的结果及范围见表2。本研究中来源于肺癌的肝脏转移瘤的平均ADC值明显低于其他来源的肝脏转移瘤的平均ADC值, 差异有统计学意义(P< 0.05)。来源于胰腺癌的肝脏转移瘤的平均ADC值明显高于其他来源的肝脏转移瘤的平均ADC值, 差异有统计学意义(P< 0.05)。来源于胃直肠癌、肝癌、乳腺癌的肝脏转移瘤的平均ADC值间的差异无统计学意义。
| 表2 不同组织来源间的肝脏转移瘤平均ADC值及范围( |
近年来, 随着DWI技术在腹部的广泛应用, 有关DWI诊断肝脏内常见占位性病变的报道[1, 3, 4, 5, 6]越来越多。国内外研究结果一致认为, 恶性病变的ADC值明显低于良性病变, 且大多以ADC值(1.40~1.60)× 10-3 mm2/s为肝脏内良恶性肿瘤的诊断界值[1, 4, 5]。本研究中276处肝脏转移瘤的平均ADC值为(1.08± 0.24)× 10-3 mm2/s, 与报道基本符合。而且, 肝脏转移瘤的ADC值取值范围分布比较广泛, (0.41~1.94)× 10-3 mm2/s, 平均ADC值位于中等值范围内。因为即使是同一种恶性肿瘤, 因其病程不同, 细胞分化也不一致, 肿瘤细胞的排列方式、细胞密度、周围间质亦存在差异, 从而导致ADC值不同。Muhi等[6]研究结果表明, 组织分化的差别和血供的差别导致肝癌的ADC值有差异。李菲等[7]研究也表明, 分化程度不同的肺癌间ADC值差异有统计学意义。肝脏转移瘤的组织分型与其原发肿瘤是相同的, 本研究中的肝脏转移瘤来源于不同的原发肿瘤, 不同的组织来源、不同的病生理过程导致了其ADC值的分布比较广。胃直肠癌组、乳腺癌组、肝癌组的平均ADC值以中等值为主, 而肺癌组的平均ADC值以低值为主, 低于本研究中总的肝脏转移瘤的平均ADC值, 胰腺癌组平均ADC值以高值为主, 高于本研究中总的肝脏转移瘤的平均ADC值。
肝脏内良恶性病变组织细胞密度的差异导致水分子扩散特性的不同, 反映其组织来源和其生物侵袭性[8], 恶性肿瘤细胞普遍特点是细胞核大, 核浆比例失调, 细胞排列紧密, 细胞外间隙小, 细胞间水分少, 水分子扩散自由度减小。但不同组织来源的肝转移瘤细胞排列紧密程度是不同的, 肿瘤内纤维基质、钙化程度亦不同, 核质比不同, 或者肿瘤内某些特色物质含量不同, 都将导致其ADC值有差异。Meyer等[9]报道小细胞肺癌的脑转移瘤的ADC值明显低于非小细胞肺癌、乳腺癌及恶性黑色素瘤的脑转移瘤的ADC值, 差异有统计学意义。本研究显示, 来源于肺癌的肝脏转移瘤的平均ADC值明显低于来源于胃直肠癌、肝癌、乳腺癌、胰腺癌的肝脏转移瘤的平均ADC值, 差异有统计学意义。表明肺癌组的肝脏转移瘤较其他肿瘤组的细胞密度大, 核质比大, 所以平均ADC值较低。小细胞肺癌的肿瘤细胞通常由小圆形或卵圆形的癌细胞组成, 类似淋巴细胞, 相对其他肿瘤细胞体积小, 呈弥漫或片状分布, 明显重叠, 相互挤压, 细胞密度高, 细胞內液较少, 细胞外间隙小, 导致肿瘤病灶在DWI序列上扩散明显受限, 因此ADC值较低[7, 10]。本研究中未对肺癌组进行进一步分组, 其中小细胞肺癌53处占肺癌组的84.1%, 是导致肺癌组的平均ADC值降低的重要原因。
本研究结果显示, 来源于胰腺癌的肝脏转移瘤的平均ADC值明显高于来源于胃直肠癌、肝癌、乳腺癌、肺癌的肝脏转移瘤的平均ADC值。可能由于胰腺癌的异型细胞形成不规则, 形成管状或腺体样结构, 腺管样结构区域常产生黏液[11, 12], 因此导致了胰腺癌组的平均ADC值高于其他来源组。国内外相关的报道较少, 有待于在今后的工作中进一步印证。
本研究存在一定的局限性。首先, 入选的实验样本数较少, 可能导致统计学上的误差; 其次, 选择的病灶大多数直径大于10 mm, 有可能导致所得的平均ADC值不能完全体现其组织特性。
总之, 肝脏转移瘤的平均ADC值取值范围较广, 以中等值为主。来源于胰腺癌的肝脏转移瘤的平均ADC值高于其他来源组的, 来源于肺癌的肝脏转移瘤的平均ADC值低于其他来源组的。ADC值在肺癌来源的肝脏转移瘤及胰腺癌来源的肝脏转移瘤的诊断中有一定的价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|