作者简介:尹黎英,在职研究生,主任医师。
目的 观察胰岛素抵抗大鼠认知行为及海马阿尔茨海默病(Alzheimer disease, AD)样病理改变,研究罗格列酮(rosiglitazone,RSG)对其认知及AD样病变的干预作用及可能的机制。方法 建立胰岛素抵抗大鼠模型,将成模的20只大鼠随机分为胰岛素抵抗(insulin resistance,IR)组和罗格列酮(RSG)组,每组10只,未造模的正常大鼠作为对照(CTL)组( n=10)。RSG组予高脂高糖高蛋白饮食+罗格列酮片3.0 mg/(kg·d)灌胃4周;IR组予高脂高糖高蛋白饮食+等量生理盐水灌胃4周;CTL组予普通饮食+等量生理盐水灌胃4周。观察指标为各组大鼠血糖、血浆胰岛素水平、胰岛素抵抗指数(IRI)、水迷宫行为能力测定、海马中IDE、pAKT、Aβ蛋白表达。结果 IR组与RSG组胰岛素抵抗指数(8.56±0.43和3.82±0.38)较CTL组(2.27±0.25)高,而RSG组低于IR组。IR组和RSG组大鼠第4天逃避潜伏期[(63.21±5.67)s和(37.48±5.41)s]较CTL组[(24.14±5.49)s]明显延长;IR组和RSG组穿越原平台象限时间占总时间百分比[(21.88±3.85)%和(33.43±2.98)% ]较CTL组[(39.57±4.31)%]减小,而RSG组较IR组明显延长。IR组和RSG组Aβ40蛋白阳性表达(0.27±0.023和0.56±0.011)较CTL组(0.13±0.021)强,而RSG组较IR组弱。上述差异均有统计学意义( P<0.01或 P<0.05)。结论 胰岛素抵抗大鼠认知行为明显下降,罗格列酮可改善其认知行为,减轻Aβ在海马的沉积。其机制可能与通过胰岛素通路PI3K/AKT介导的IDE上调,增强IDE对Aβ的降解相关。
Objective To study the insulin resistance rat cognitive behavior and hippocampal Alzheimer disease (AD) - like pathological change, to study the intervention effect of rosiglitazone (RSG) on the cognitive and AD- like lesions and its possible mechanism.Methods The rat models of insulin resistance were established and 20 successful models were randomly divided into the insulin resistance(IR)group( n=10) and rosiglitazone (RSG) group, each group of 10,the normal rats as control (CTL)group( n=10).The rats in RSG group were given high-protein diet with high fat and sugar +RSG 3 mg/kg/d by gavage for 4 weeks. IR group were given high-protein diet with high fat and sugar + equivalent saline by gavage for 4 weeks.CTL group were given general diet + equivalent saline by gavage for 4 weeks. The observation indexes included the blood glucose,plasma insulin levels(FINS),insulin resistance index(IRI),Morris water maze test,insulin degrading enzyme (IDE),response to insulin sialing pathway of pAKT,and Aβ protein expression in hippocampus.Results The IRI in IR group and RSG group(8.56±0.43 and 3.82±0.38)is low than that in CTL group(2.27±0.25),but in RSG group was lower than in IR group. The 4 day escape latency of rats in IR and RSG groups[(63.21±5.67)s and(37.48±5.41)s] was significantly longer than in CTL group [(24.14±5.49)s].The through the platform quadrant percentage of total time in IR and RSG groups [(21.88±3.85)% and (33.43±2.98)%] was smaller than in CTL group [(39.57±4.31)%],but RSG group is superior to IR group. The Aβ protein expressions in IR group and RSG groups (0.27±0.023 and 0.56±0.011)was stronger than that in CTL group(0.13±0.021), but RSG group is weaker than IR group. These differences were statistically significant ( P<0.01 or P<0.05).Conclusions Insulin resistance rats can develop cognitive behavior decrease and aβ deposition AD like pathological changes.RSG can improve the cognitive behavior, reduce the aβ in the hippocampus of deposition, its mechanism may be through the insulin pathway mediated by IDE PI3K/AKT,to enhance IDE of aβ, thereby reducing degradation deposition.
近年诸多研究证实, 胰岛素抵抗与阿尔茨海默病(Alzheimer disease, AD)的发生存在相关性[1], 2型糖尿病患者比健康人更易出现认知功能障碍及脑组织AD样病变[2]。胰岛素抵抗可加速神经纤维缠结、tau蛋白呈过度磷酸化, 从而促进AD发生。那么胰岛素抵抗是否与AD的另一病理改变, 即Aβ 在脑内的大量沉积相关, 是本研究的主要目的之一。
Aβ 在脑内的代谢失衡是导致其大量沉积形成老年斑的根本原因[3]。胰岛素降解酶(insulin degrading enzyme, IDE)可降低Aβ 的神经毒性, 并减少其沉积。一方面, 胰岛素可以竞争性地与IDE结合, 从而抑制了IDE对Aβ 的降解; 另一方面, IDE是胰岛素信号通路PI3K/AKT下游的一个调节靶位, 增强此通路可以上调IDE[4]。罗格列酮(RSG)已被证实可以激活PI3K/AKT通路, 增强胰岛素敏感性[5]。据此, 笔者推测RSG可以通过激活PI3K/AKT通路, 上调IDE, 增强对Aβ 的降解。因此, 本研究基于如上理论, 旨在进一步求证胰岛素抵抗大鼠的认知行为改变及AD样病变, 并观察RSG的干预效果及其作用机制。
健康雄性Wistar大鼠40只, 体重180~220 g。随机选取30只给予高脂高糖高蛋白饮食, 热量百分比为碳水化合物26%, 蛋白质15.2%, 脂肪(炼猪油)58.8%。另外10只给予普通饮食。3个月后, 用血糖仪检测大鼠空腹血糖(fasting blood glucose, FBG)与胰岛素(fasting insulin, FINS)水平, 采用放射免疫法计算胰岛素抵抗指数(insulin resistance index, IRI)并筛选出符合胰岛素抵抗模型的大鼠(依据喂高糖高脂高蛋白饲料IRI大于普通饲料大鼠IRI均数加1.96个标准差)。将成模的20只大鼠随机分为胰岛素抵抗(IR)组和罗格列酮(RSG)组, 每组各10只。RSG组予以高脂高糖高蛋白饮食+罗格列酮片3.0 mg/(kg· d)灌胃, 持续4周; IR组予以高脂高糖高蛋白饮食+等量生理盐水灌胃, 持续4周。另外普通饮食的10只作为对照组(CTL), 等量生理盐水灌胃4周。灌胃4 周后处死所有动物。大鼠饲养室温为20 ℃, 自由饮水, 天黑前投食, 自然昼夜节律光照。
1.2.1 一般指标 (1)血糖测定:处死前尾静脉采血, 用血糖仪检测血糖水平。(2)血浆胰岛素测定:处死前心脏取血1 ml, 离心后留取血浆, 用放射免疫法检测胰岛素的水平。药盒购自北京原子能研究所, 测定值批内 CV< 2.5%, 批间CV< 3.5%。以IRI=FBG(mmol/L) × FINS(U/L)/22.5表示胰岛素抵抗指数。
1.2.2 Morris水迷宫试验 灌胃第4周, 各组大鼠在处死前5 d开始进行Morris水迷宫行为能力测试[6]。数据采集和处理由Morris水迷宫图像自动监视处理系统完成。
1.2.3 海马中IDE、pAKT、Aβ 蛋白表达的检测
1.2.3.1 制备脑组织切片 灌胃4周后, 以10%水合氯醛腹腔注射麻醉大鼠, 打开胸腔, 充分暴露心脏, 于左心室插入灌注针并固定, 剪开右心耳, 200 ml生理盐水快速持续灌洗, 待右心耳可见清澈液体流出, 然后改用4%多聚甲醛200 ml先快后慢灌注固定, 直至大鼠肝脏变白, 全身僵硬, 快速断头取脑, 置于4%多聚甲醛固定6 h, 然后置于30%蔗糖溶液中脱水至组织块下沉。用滤纸吸干脑表面蔗糖溶液, OCT液氮中包埋, -80 ℃冻存。将冻好的脑组织放入恒冷箱冰冻切片机做冠状切片, 厚度为10 μ m, 海马部位的切片依次存放备用。
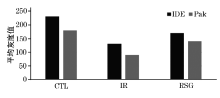
1.2.3.2 MAP2、IDE、pAKT免疫荧光双标染色 冷冻海马切片经室温干燥、洗涤、封闭后加一抗, 分别为兔抗IDE多克隆抗体(1∶ 2500)、兔抗pAKT多克隆抗体(1∶ 500), 4 ℃过夜; PBS洗涤后加二抗, 羊抗兔-TRITC(1∶ 50), PBS洗涤后再加小鼠抗MAP-2(1∶ 500) 4 ℃过夜; PBS洗涤后加二抗, 羊抗小鼠-FITC(1∶ 50); 最后PBS洗涤甘油封片, 荧光显微镜下拍照。随机选取海马部位4个高倍视野, 用Image Pro 5.0 Plus对IDE、pAKT的表达进行分析, 并计算其平均灰度值。
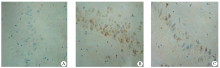
1.2.3.3 免疫组化检测Aβ 表达 海马切片常规经抗原修复, 消除内源性过氧化物酶, 滴加一抗:兔抗鼠Aβ (1-40)(1∶ 200), 4 ℃过夜; 从冰箱取出后室温放置20 min, PBS洗涤, 加二抗:羊抗兔PV-6001, 37 ℃温箱孵育30 min, PBS洗涤。DAB显色, 自来水冲洗, 苏木精复染, 冲洗, 最后脱水, 透明, 中性树胶封片。光镜下观察神经细胞胞浆呈棕黄色为阳性, 每张切片高倍镜下选择4个视野, 并计算平均光密度值。
所有数据均用SPSS13.0软件进行分析。计量资料以
3个月不同饮食喂养后, 3组之间的血糖比较, 差异无统计学意义; IR组与RSG组胰岛素水平及IRI较CTL组增高, 差异有统计学意义(P< 0.05); RSG组胰岛素水平及IRI较IR组低(P< 0.01, 表1)。
| 表1 3个月不同饮食喂养后3组大鼠一般指标的比较(n=10; |
IDE/MAP-2免疫荧光双标染色可见, IR组及RSG组荧光强度较CTL组减弱, 而RSG组较IR 组荧光强度则有所增强; pAKT免疫荧光的变化趋势与IDE一致(图1)。
前4 d的定位航行实验中, 各组大鼠的逃避潜伏期均呈下降趋势; IR组和RSG组大鼠平均逃避潜伏期较CTL组明显延长(P< 0.01或P< 0.05); RSG组较IR组平均逃避潜伏期明显缩短(P< 0.01)。第5天空间探索实验IR组和RSG组较CTL组穿越原平台象限时间占总时间百分比减小(P< 0.01或P< 0.05); 而RSG组较IR 组明显增大(P< 0.01, 表2)。
| 表2 3组大鼠Morris水迷宫实验比较(n=10; |
流行病学资料显示, T2DM可以促进AD的发生[7]。T2DM以胰岛素抵抗及高胰岛素血症为特征。胰岛素抵抗是由于各种原因导致体内胰岛素升高而其有效浓度及生物效能下降, 从而导致的胰岛素相对不足。胰岛素的这种变化不仅存在于外周, 同时也存在于中枢神经系统。脑内的胰岛素可以通过其相应的胰岛素受体发挥重要的生物学效应, 如调节新陈代谢、促进神经组织生长发育、参与学习记忆等高级智能活动; 而胰岛素抵抗则可导致脑内细胞代谢紊乱, 能量代谢障碍, 从而使得学习记忆等智能活动受损并诱发AD样病理级联反应[8]。
本研究发现, 通过持续予以大鼠高糖高脂高蛋白饮食3个月, 血浆胰岛素水平及IRI明显升高, 成功地建造了胰岛素抵抗模型, 并通过Morrir水迷宫实验发现此类大鼠存在着认知行为的下降, 并在大鼠海马组织中检测到大量的Aβ 沉积, 实验结果进一步证实了胰岛素抵抗可以发生AD样症状及病理改变。Aβ 的沉积与IDE的作用密切相关, IDE是其降解过程中的主要酶, 高胰岛素竞争性的与IDE相结合, 从而抑制了IDE对Aβ 的降解。本研究中也发现, 胰岛素抵抗大鼠血浆胰岛素水平升高, 脑中的IDE蛋白表达明显减少, 而Aβ 的沉积明显增多, 与之前的研究结果相一致。如果可以提高脑内IDE的浓度, 便可增加对Aβ 的降解。研究人员证实IDE是脑内胰岛素的信号传导通路中的PI3K-PKB/AKT途径下游的一个靶位, 所以这条途径的激活, 可以对IDE起到上调作用[9]。
RSG是噻唑烷酮类化合物属于胰岛素增敏药, 在T2DM中的临床治疗中已得到认可。RSG可以与PPARr特异性结合, 激活胰岛素信号通路, 改善胰岛素抵抗和高胰岛素血症[2]。本研究结果表明, RSG组大鼠的血浆胰岛素水平及IRI明显下降, 说明RSG可以对抗胰岛素抵抗状态; 在进行了4周RSG灌胃后, 发现PI3K-PKB/AKT通路上pAKT的上调, 并同时检测到大鼠海马组织中IDE的蛋白表达增加及Aβ 的沉积减少, 说明RSG可以通过激活胰岛素信号通路PI3K-PKB/AKT使得IDE上调, 从而增加对Aβ 的降解, 减少其沉积, 说明RSG对AD样病变有减轻作用; 另外Morrir水迷宫实验检测结果显示, RSG组大鼠的认知行为较IR组明显好转, 说明RSG对胰岛素抵抗大鼠的AD样症状有缓解作用。
综上所述, 本研究证实了胰岛素抵抗大鼠可以发生AD样病变和认知行为的改变。而在RSG的作用下, 一方面可以通过激活脑内胰岛素的信号传导通路上调IDE, 增加对Aβ 的降解, 减少其在脑组织的沉积, 改善胰岛素抵抗大鼠的认知行为; 另一方面减轻了脑内的高胰岛素血症, 使得Aβ 与IDE的结合不会被胰岛素竞争性地抑制, 从而增加Aβ 的降解减少其沉积。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|