探讨18F-FDG PET/CT对儿童神经母细胞瘤(neuroblastoma, NB)近期疗效评估的应用价值。
方法回顾性分析我院2012-04至2015-04收治的14例行18F-FDG PET/CT检查的NB患儿临床资料,观察18F-FDG PET/CT对NB患儿疗效的评估及对复发、转移病灶的检出情况。
结果14例NB患儿共行18例次18F-FDG PET/CT检查,其中8例次显示不同程度、不同部位的FDG异常摄取增高灶,指导临床及时调整了治疗。18F-FDG PET/CT改变了1例患儿分期, 由初始Ⅳs期提高至Ⅳ期。4例复发患儿共17处病灶,18F-FDG PET/CT对复发、转移病灶的检出率为88.2%(15/17),遗漏1处颅内微小转移灶和1例骨髓微小转移。
结论18F-FDG PET/CT对儿童NB近期疗效的评估具有重要价值,可作为NB患儿随访的辅助检查之一。
To investigate the clinical value in the evaluation of the short-term efficacy of18F-FDG PET/CT in children with neuroblastoma (NB).
MethodsClinical data of 14 NB patients undergoing18F-FDG PET/CT examination were recruited from April 2012 to April 2015 in this hospital. We evaluated the therapeutic efficacy in NB children and detected recurrent lesions.
Results14 NB children received totally 18 times18F-FDG PET/CT examinations. Among them, 8 cases showed different degree and different parts with abnormal increased uptake of FDG, which guided to adjusting clinical treatment promptly.18F-FDG PET/CT changed one case’s stage, increasing from the initial stage Ⅳs to stage Ⅳ. 4 children who suffered relapse had a total of 17 lesions. The detection rate of18F-FDG PET/CT for recurrent and metastatic lesions was 88.2% (15/17), missing one small intracranial metastasis and one case of bone marrow micro-metastasis.
Conclusions18F-FDG PET/CT has an important value in the evaluation of the short-term efficacy of NB children, and can be used as follow-up examination of NB in children.
神经母细胞瘤(neuroblastoma, NB)是儿童最常见的颅外恶性实体肿瘤, 具有恶性程度高、早期易转移、生物学行为多样性等特点, 多数患儿就诊时已为Ⅲ ~Ⅳ 期, 预后差[1]。目前, 临床多通过联合超声、CT、MRI、骨髓穿刺等多项检查评价小儿NB疗效, 但上述检查部位相对局限, 易遗漏远处转移灶, 难以评价残留病灶有无活性, 且骨穿为有创检查, 血小板太低时不能操作。因此, 寻找一种新的检查手段以更好地评估NB疗效显得尤为重要。
18F-FDG PET/CT不仅可以显示肿瘤的解剖部位、大小及形态, 还可反映肿瘤细胞的代谢状况, 从而较好地评价瘤负荷大小、早期发现微小病灶及远处转移灶, 近年来在小儿NB诊断、分期中得以应用[2, 3, 4]。笔者收集14例NB患儿的18例次18F-FDG PET/CT资料, 探讨18F-FDG PET/CT对儿童NB近期疗效评估中的应用价值。
收集武警总医院儿科2012-04至2015-04经病理确诊为NB的住院患儿临床资料, 选择有18F-FDG PET/CT资料者14例, 男9例, 女5例; 年龄9~96个月, 中位年龄25个月。分期标准参照国际NB分期系统(INSS)[5] , 其中Ⅲ 期4例, Ⅳ 期9例, Ⅳ s期1例; 分组标准参照中国儿童NB协作组危险度分级系统, 其中中危组8例, 极高危组6例。所有病例均经规律治疗且有完整的随访资料。
1.2.1 18F-FDG PET/CT显像 采用德国siemens Biograph Sensation l6HR PET/CT显像仪。受检者需空腹6~8 h, 显像前测量身高、体重和血糖水平, 并尽量排空膀胱。按0.10~0.15 mCi/kg的剂量静脉注射18F-FDG; 自注药后30 min开始, 嘱患儿饮水约300 ml以保证胃肠道充盈良好。不能配合检查的患儿常规使用镇静药物。18F-FDG PET/CT显像范围自颅顶至双侧股骨上段; CT平扫参数为100~120 kV的峰值电压和自动曝光产生的管电流。采集层厚为5 mm, 螺距为1.0, 重建层厚为3 mm, 在CT全身扫描后即刻采集PET图像, 2 min/床位, 共采集4~6个床位。采用迭代法重建PET图像, 并传送到Wizard工作站进行图像融合。所有图像均经2名主治医师共同阅片, 意见不一致时由上级医师参与阅片并达成一致意见。
1.2.2 治疗 14例中, 1例Ⅳ s期经术前3个疗程化疗后切除了原发灶, 13例均进行了术前化疗→ 手术切除→ 术后化疗。NB化疗方案包括:(1)长春新碱+环磷酰胺+表柔比星; (2)环磷酰胺+伊立替康; (3)顺铂+依托泊苷; (4)长春新碱+环磷酰胺+顺铂+依托泊苷。以上方案交替使用, 中危者采用(1)、(2)、(3)方案交替治疗, 极高危者采用(1)、(2)、(4)方案交替治疗。Ⅲ 期者共化疗6~9个疗程, Ⅳ 期者共化疗9~12个疗程。大于3岁能配合放疗者, 化疗至非常好的部分缓解(VGPR)[6]后4个疗程, 再进行放疗。对部分化疗耐受性差或复发转移的患儿加用免疫细胞生物治疗。除1例Ⅳ s期外, 其余患儿静脉化疗结束后均口服13-顺式维甲酸, 剂量为160 mg/m2, 口服14 d, 停14 d, 交替进行, 共半年。在治疗中出现病情进展者, 进入个体化治疗。
1.2.3 随访 全部治疗结束后, 定期回院复查。复查项目包括原发部位超声/增强CT/增强MRI, 骨髓穿刺, 骨扫描, 18F-FDG PET/CT, 神经元特异性烯醇化酶(NSE)、乳酸脱氢酶、血清铁蛋白。以上复查项目由主治医师根据患儿初诊情况、后续治疗情况和复诊时临床表现进行选择性检查。复诊时间为停药后每月1次, 连续3次; 后延长为每3个月1次, 连续3次; 再延长至每半年1次, 连续2次; 最后为每年1次; 总复诊时间定为5年。14例均通过电话和(或)回院复诊进行随访, 随访时间截至2015-11-30。
1.2.4 统计学处理 采用SPSS17.0进行数据分析与处理, 正态分布资料采用均数进行描述, 非正态分布资料采用中位数进行描述。
14例共行18例次18F-FDG PET/CT检查, 其中4例(病例2、5、6、8)在术后化疗3个疗程后及全部治疗结束8周后各检查1次, 1例(病例14)为术后半年检查1次, 余9例为全部治疗结束8周后检查1次。随访时间12~43个月, 平均21.4个月; 10例无病生存, 2例复发带瘤生存, 另外2例因复发、转移死亡。14例NB患儿随访资料见表1。
18例次18F-FDG FET/CT结果中:(1)10例次(均为全部治疗结束8周后)显示肿瘤治疗后达到完全缓解(CR), 表现为全身未见异常高代谢肿瘤残留复发病灶。该10例患儿在随访过程中经多次超声、增强CT和(或)骨扫描、骨髓穿刺检查验证, 均未发现肿瘤残留复发迹象, 且与最终随访结果相符。(2)8例次显示不同程度、不同部位的FDG异常摄取增高灶, 其中3例次为术后化疗3个疗程后检查1次:病例2经二次手术、术后化疗及免疫细胞生物治疗后达到CR, 病例5和病例8经术后化疗和放疗后亦达到CR。另外4例(病例6、11、13、14)出现复发, 18F-FDG PET/CT 显示多部位异常高代谢病灶, 其中病例13、14立即接受了复发后的追加治疗, 效果良好, 目前带瘤生存; 病例6、11在复发后亦立即接受了追加治疗, 但效果欠佳, 病情快速进展, 于复发后1个月内死亡。
经18F-FDG FET/CT检查后, 病例14由初始Ⅳ s期提高至Ⅳ 期。但有1例(病例10)为治疗结束后骨髓微小残留(经反复骨髓流式细胞术验证), 但18F-FDG PET/CT显示骨髓未见FDG异常摄取增高。
| 表1 14例神经母细胞瘤患儿18F-FDG PET/CT(治疗结束8周后)随访资料 |
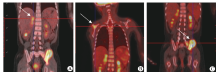
4例复发患儿共有17处病灶, 包括原位复发病灶4处, 淋巴结转移病灶6处, 颅内转移病灶2处, 咬肌转移病灶1处, 骨转移2例和骨髓转移2例。其中1例Ⅳ 期极高危组患儿(病例13)出现原位复发伴多发骨转移(图1)。18F-FDG PET/CT共检出17处病灶中的15处, 检出率为88.2%, 遗漏1处颅内微小转移灶和1例骨髓微小转移。4处原位复发灶经增强CT全部检出, 超声检出2处, 另外2处被超声认为是术后纤维瘢痕组织。2处颅内转移和1处咬肌转移病灶均被增强MRI检出。2例骨转移者均被骨扫描检出。2例骨髓转移者均经骨髓流式细胞术检出。4例复发患者血清NSE值均较上一次突然升高> 3倍, 由(23.50± 5.24) ng/ml升高至(120.17± 47.24) ng/ml。
国内外已形成多学科协作诊疗模式, 如采用联合化疗、手术、放疗及造血干细胞移植等治疗方案, 使NB患者5年生存率较前明显提高[7]。但晚期NB患儿病情进展迅速, 治疗难度居高不下, 长期生存率仍不足30%[8, 9]。就NB患者而言, 早期诊断和及时准确地评估疗效, 既有助于及早实施治疗方案, 又有助于监测复发、转移, 还可避免过度治疗带来的相关脏器损伤, 能更好地指导临床诊治。
近年来, 为科学准确地对NB患儿进行诊断、分期及疗效监测, 多种显像技术已成为研究热点, 而18F-FDG PET/CT凭借PET与CT的联合优势在多种新型影像学检查中备受关注。研究表明, 18F-FDG PET/CT在儿童NB的淋巴结、骨、骨髓等转移灶检出中具有较高的敏感性与特异性[10]。本组14例患儿18F-FDG PET/CT结果与病情均相符, 阳性病灶表现为不同程度、不同部位的FDG异常摄取增高灶, 较灵敏地检出隐匿部位的转移病灶, 改变了1例患儿临床分期, 在NB近期疗效的评估中提供了肿瘤代谢信息。18F-FDG PET/CT仅遗漏1例骨髓微小残留, 这与田月丽等[11]报道的18F-FDG PET/CT在观察微小肿瘤时存在假阴性相符。当肿瘤小于0.5 cm或肿瘤细胞代谢处于被抑制状态而导致细胞内18F-FDG摄取低时, 则会出现假阴性。分析该假阴性病例存在的原因可能为骨髓残留比例过小, 或骨髓残留恶性细胞的糖代谢被抑制而难以被18F-FDG PET/CT发现。对于此类病例应密切随访观察, 以早期发现病情变化。
李佳宁等[3, 12]和王剑杰等[4]研究发现, 18F-FDG PET/CT不仅能够为儿童NB的诊断和分期提供客观依据, 而且在确定术后残留复发方面具有潜在价值。本组14例NB患儿最终有4例复发, 共17处病灶, 18F-FDG PET/CT遗漏了1处颅内微小转移灶和1例骨髓微小转移, 而分别被增强MRI和骨髓流式细胞术检出。相比之下, 18F-FDG PET/CT对颅内和骨髓微小病灶的检出率不如增强MRI和骨髓流式细胞术。考虑原因可能为:(1)颅内脑组织代谢旺盛, 正常情况下摄取18F-FDG较多, 产生放射性浓聚, 容易干扰18F-FDG PET/CT对颅内微小病灶异常浓集的判断; (2)骨髓中有微小转移灶或患者近期使用过粒细胞刺激因子等改变骨髓增生程度的药物时, 18F-FDG PET/CT显像可能呈现出分布欠均匀的放射性浓集, 从而影响对真正异常浓聚灶的判断。因此, 18F-FDG PET/CT不能取代增强MRI及骨髓流式细胞术在NB疗效评价中的地位。
本研究中, 复发患儿的4处原位复发灶均被18F-FDG PET/CT和增强CT检出, 2例骨转移均被18F-FDG PET/CT和骨扫描检出。Choi等[13]观察了30例NB患儿的18F-FDG PET资料, 发现18F-FDG PET/CT在检测远处淋巴结方面优于CT, 以及在发现骨转移方面明显优于骨扫描, 并提出在有18F-FDG PET/CT的条件下, 骨扫描可能被淘汰。但在国内, 多位学者强调CT及骨扫描在NB患儿诊治中具有重要作用[14, 15]。笔者认为, 虽然18F-FDG PET/CT在NB复发、转移的监测中能提供更全面的信息, 但考虑到其价格昂贵及对辐射风险的担忧等问题, 目前18F-FDG PET/CT仍仅能作为NB患儿的一种选择性检查, 短时间内不可能取代增强CT和骨扫描。
若NSE突然异常增高, 往往提示NB患儿已经出现复发或转移[16]。本研究4例复发患儿NSE均突然升高> 3倍, 且18F-FDG PET/CT阳性, 由此可见, 突然升高的NSE在预测NB复发方面与18F-FDG PET/CT拥有一致性。NSE的检测较为方便、经济、快捷, 可根据病情需要进行实时监测, 与18F-FDG PET/CT联合来早期监测NB复发、转移可能更准确。但对于NSE值较前突然升高多少可以判断NB复发、转移, 以及与18F-FDG PET/CT联合后的确切优势, 均需要进一步扩大样本量进行对比研究。
综上所述, 18F-FDG PET/CT作为一种全身性的检查, 较任何单一传统影像学检查能更全面地对儿童NB近期疗效做出评价, 但其与传统检查各有优劣, 目前不能相互取代。由于18F-FDG PET/CT在国内临床应用时间较短、价格昂贵及对辐射风险的担忧等原因, 至今未广泛在儿童NB随访中得以应用。而本组病例样本量较小, 且缺乏治疗前的18F-FDG PET/CT作对比, 为明确其在NB患儿疗效评估中的确切作用, 以及最佳检查时间、复查间隔, 对不同分期患儿的评估作用有无差异等, 还需要更多的临床应用数据来进一步探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|