探讨含伊立替康联合环磷酰胺方案对晚期神经母细胞瘤(neuroblastoma ,NB)患者的临床疗效及安全性。
方法回顾性总结分析武警总医院儿科自2008-05至2015-09收治的采用含伊立替康联合环磷酰胺方案(观察组)治疗的18例晚期神经母细胞患者临床资料,并与采用未含伊立替康联合环磷酰胺方案(对照组)治疗的18例晚期NB患儿进行比较,分析并总结伊立替康联合环磷酰胺治疗晚期NB临床疗效和安全性。
结果至2015-09-30,(1)疾病总有效率观察组(55.6%)高于对照组(27.8%),差异无统计学意义;疾病总控制率观察组(77.8%)高于对照组(38.9%),差异有统计学意义( P<0.05);(2)中位无进展生存期、中位总生存期观察组(31个月,28个月)较对照组高(15个月,17个月),差异有统计学意义( P<0.05);(3)随访时间达1年患者,观察组15例,对照组18例,1年生存率观察组(100%)高于对照组(61.1%),差异有统计学意义( P<0.05);(4)用药期间不良事件主要包括恶心、呕吐等消化道症状及骨髓抑制相关的血液学毒性,观察组发生血小板下降、贫血、转氨酶增高较对照组少。
结论伊立替康联合环磷酰胺用于治疗晚期神经母细胞瘤,疗效肯定,且未发生严重的毒副反应。
To study the clinical efficacy of irinotecan plus cyclophosphamide in children with advanced neuroblastoma (NB).
MethodsWe summarized clinical data of 18 children with advanced neuroblastoma who were treated with irinotecan plus cyclophosphamide (observation group) between May 2008 to September 2015 in the General Hospital of Peoples Armed Forces. Another 18 cases with advanced neuroblastoma received non irinotecan plus cyclophosphamide chemotherapy were employed as control group.The efficacy and safety were reviewed.
ResultsAs of September 30,2015, The disease control rate in observation group(55.56%)was higher than that in control group(27.8%); The responsive rate in observation group (77.78%) was higher than that in control group (38.9%).The progression-free survival and overall survival of observation group (31 months,28 months) was higher than that in control group(15 months,17 months)( P<0.05).In the observation group, 15 cases were followed up for 1 year, 18 cases in the control group were followed up for 1 year. The 1 year survival rate in the observation group (100%) was higher than that in the control group (61.1%, P<0.05). The dose-limiting toxicity(DLT) included nausea, vomiting, diarrhea and other gastrointestinal symptoms and bone marrow suppression of hematology toxicity. Thrombocytopenia, anemia, elevated aminotransferase in control group were higher than that in the observation group ( P<0.05).
ConclusionsIrinotecan combined with cyclophosphamide used for treatment of advanced NB has certain curative effects without extra side effects.
神经母细胞瘤(neuroblastoma, NB)是儿童颅脑外最常见的神经系统实体肿瘤, 其恶性程度高, 进展快。临床上虽采用化疗、手术、放疗等综合治疗, 晚期神经母细胞瘤患者的5年无病生存率仍低于40% [1, 2]。目前, 我国晚期儿童NB采用以化疗+手术+放疗+13-顺维甲酸为主的治疗, 随着化疗疗程的增加, 化疗疗效逐渐减低, 毒副反应及耐药性却逐渐增加。伊立替康(Irinotecan, CPT-11) 是半合成喜树碱衍生物, 为拓扑异构酶I(Topo I)抑制剂, 可阻断DNA复制叉, 最终导致肿瘤细胞死亡, 目前, 主要用于晚期结肠癌患者的治疗[3, 4]。近年来, 欧美临床前研究和临床实验结果表明, CPT-11在治疗NB中有一定疗效, 但其在临床应用的报道甚少, 对于其疗效和安全性的探索是目前的研究重点。本研究通过收集使用伊立替康联合环磷酰胺方案治疗的18例晚期NB患儿的资料, 并与未使用伊立替康联合环磷酰胺方案治疗的患儿进行对比分析, 探讨伊立替康联合环磷酰胺在儿童晚期NB近期疗效及安全性。
选择2011-08至2015-09我院儿科收治的18例采用含伊立替康联合环磷酰胺治疗、随访资料完整的晚期NB患者, 记为观察组, 同时选取2008-05至2014-1118例采用未含伊立替康联合环磷酰胺方案, 且性别、年龄、临床分期及疗程与之匹配的患者18例列入对照组。36例均经临床诊断和(或)病理确诊。
所有患者术前均根据典型影像学特征、骨髓细胞学检查、24 h尿香草扁桃酸(VMA)、神经元特异性烯醇化酶(NSE)、血清铁蛋白(SF)水平进行临床诊断, 均经术前化疗后进行手术病理确诊。所有患儿均行影像学检查, 包括放射性核素扫描、CT、磁共振成像, 部分患儿行正电子发射计算机断层显像检查(positron emission tomography-computedtomography, PET-CT) , 全部患儿进行骨髓细胞学检查、骨髓流式细胞术肿瘤细胞检测。按国际神经母细胞瘤分期系统(international neuroblastoma staging system, INSS) 分期标准进行分期, 其中Ⅲ 期6例, Ⅳ 期30例。36例一般资料见表1。
| 表1 36例神经母细胞瘤患儿一般资料(n=18) |
36例均无直接行手术者, 术前化疗1~3个疗程, 最长达4~6个疗程, 经检测肿块缩小明显, 与血管关系显露可耐受手术者可行手术切除, 术后化疗Ⅲ 期行6~8个疗程, Ⅳ 期行9~12个疗程, 个别患者根据临床耐受情况调整。化疗方案具体见(表2)。观察组采用化疗方案①+②+③+④, 对照组采用方案①+②+③。术后对于大于3岁能配合放疗患者, 进行原发部位和(或)转移部位的放疗。化疗全部结束后均口服13-顺式维甲酸诱导分化治疗, 剂量为160 mg/m2, 第1~14天口服, 停14 d, 交替进行, 共6个月。所有患者在化疗期间, 给予应用昂单司琼注射液止吐。在化疗结束后, 采用重组人粒细胞集落刺激因子治疗粒细胞缺乏症; 输入红细胞悬液纠正贫血; 输注血小板治疗血小板降低及出血倾向; 必要时输注血浆改善凝血功能。
| 表2 神经母细胞瘤36例不同化疗方案及药物用法 |
1.4.1 总有效率、疾病控制率及获得手术机会情况 36例每次化疗前均行原发部位超声和(或)CT, 将此结果作为临床近期疗效评判的依据。近期疗效按照RECIST (response evaluation criteria in solid tumor)1.1 版疗效评价标准[5]。(1)CR (Complete Response ): 完全缓解, 所有目标病灶消失, 并维持1个月以上; 病理性淋巴结短径< 10 mm; (2)PR(partial response):部分缓解, 与基线病灶长径总和比较缩小30%, 病情稳定1个月以上; (3)PD (progressive disease):进展, 原靶病灶长径总和增加大于20%并且原靶病灶长径总和绝对值增加大于5 mm; 出现新病灶; (4)SD (stable disease ):稳定, 基线病灶长径总和有缩小但未达PR或有增加但未达PD。观察两组疾病总有效率和控制率, 有效率(response rate, RR), 即(CR + PR )/ 总例数x100%; 疾病控制率 (disease control rate, DCR), 即(CR+ PR+ SD )/总例数× 100%。观察比较两组患者获得手术概率。
1.4.2 无进展生存期和总生存期 随访截止至2015-09-30, 观察所有患者的无进展生存期(progression-free survival, PFS )和总生存期(overall survival, OS)。PFS、OS通过查阅住院病历资料和电话随访确定。治疗完全结束后进行长期随访, 每月1次, 共3个月, 如无复发或进展, 每3个月1次, 连续2次, 如仍无异常, 延长为6个月1次, 连续2次, 最后为1年1次, 总随访时间为5年。
所有患者均于每疗程化疗前行血常规、小儿生化、心电图等辅助检查; 化疗期间及治疗后, 每2~3 d行血常规检查, 每1周行小儿生化检查, 观察毒副作用, 并按照WHO抗肿瘤药物毒性反应分级分为0~Ⅳ 级。
采用SPSS 17.0统计学软件对数据进行统计学分析。计数资料的比较采用Fisher确切概率法分析比较, 两组间总生存期曲线描述采用Kaplan-Meier并用Log-rank法比较。均采用双侧检验, P< 0.05为差异有统计学意义。
化疗后, 两组临床症状均有不同程度的改善, 观察组临床有效率(55.6%)优于对照组(27.8%), 差异无统计学意义; 观察组疾病控制率(77.8%)显著优于对照组(38.9%), 差异有统计学意义(P< 0.05)。两组化疗效果比较见表3。
| 表3 两组神经母细胞瘤患者化疗效果比较(n; %) |
观察组18例患者共接受66疗程的伊立替康联合环磷酰胺化疗, 最少3个疗程, 最长7个疗程, 平均3.6个疗程。观察18例患者总疗程, 1例Ⅳ 期患儿治疗5疗程后达到PR, 9例治疗2~6个疗程后达到PR(图1); 4例治疗3~6个疗程后疾病稳定; 4例治疗4~12个疗程后出现疾病进展, 其中2例出现新病灶, 家长放弃治疗, 另2例原发部位复发。所有患者均获得手术机会。对照组3例Ⅲ 期均获得手术机会, 其中2例分别治疗3、5疗程后达到PR; 15例Ⅳ 期患儿仅3例治疗4~6个疗程后达到PR, 2例分别在3、5个疗程后疾病稳定; 11例患儿治疗3~11个疗程后出现疾病进展, 其中10例疾病进展后死亡, 3例未获得手术机会。
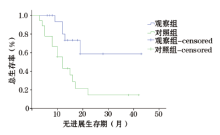
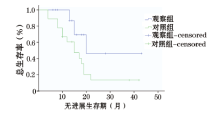
随访至2015年9月30日, 观察组随访时间6~43个月, 平均16.5个月; 对照组随访时间4~42个月, 平均15.8个月; 两组随访时间无统计学差异。观察组患者中位PFS为31个月, 对照组中位PFS为15个月, 差异有统计学意义(P=0.007, 图2)。观察组中位OS为28个月, 对照组中位OS为17个月, 差异有统计学意义(P=0.023, 图3)。随访时间达1年患儿, 观察组15例, 对照组18例, 观察组1年生存率(100%)较对照组(61.1%)高, 差异有统计学意义(P< 0.05)。
两组均没有发生与治疗相关的致死病例, 用药期间主要不良反应为骨髓抑制及胃肠道反应, 包括恶心呕吐、腹泻、三系降低等, 其中血小板下降、贫血、转氨酶增高两组间比较差异有统计学意义(P< 0.05), 恶心呕吐、腹泻、白细胞降低、心肌酶增高两组间比较差异无统计学意义(表4)。所有肝肾功能异常、心肌受损者经保心、保肝对症治疗及随着化疗结束后化疗药的停用, 均逐渐恢复正常。
| 表4 两组神经母细胞瘤患者化疗用药期间不良反应发生情况比较 |
目前, 我国NB形成化疗联合手术、放疗、13-顺维甲酸维持治疗的综合模式, 而肿瘤的生物治疗是继上述传统治疗之后新型的抗肿瘤模式。自2009年Yu AL, Gilman AL, Ozkaynak MF等[6]首次发现, GD2免疫疗法能提高高危NB生存率后, 发达国家GD2生物治疗逐渐应用于临床, 疗效肯定[7, 8]。在我国, 由于未普及婴幼儿常规体格检查, 大多数患儿就诊时已为晚期, 且受大多数家庭经济情况等原因影响, 生物治疗未能于临床推广使用, 化疗仍是目前最重要的治疗手段[9], 我国目前晚期NB的疗效总体较差, 其原因一方面由于肿瘤细胞恶性程度高, 另一方面的原因为化疗产生耐药[10], 且随着化疗时间的延长, 化疗疗效会逐渐降低, 化疗引起的脏器功能损害及耐受能力逐渐增加。
环磷酰胺为烷化剂类的细胞毒性药物, 已被证实对神经母细胞瘤有效, 属于一线药物[11]。笔者选择伊立替康联合环磷酰胺方案, 是因为伊立替康为拓扑异构酶Ⅰ 抑制药, 其活性代谢物可与拓扑异构酶I-DNA复合物发生结合, 对单链起到较好的阻断效果; 烷化剂类的细胞毒性药物细胞毒作用基于其烷化代谢物与DNA相互作用, 导致DNA链断裂及与DNA-蛋白交联的联结, 导致细胞周期中G2被延迟。国外Ⅰ 、Ⅱ 期临床研究显示伊立替康与烷化剂类细胞毒性药物替莫唑胺联合用药可以起到协同抗肿瘤的作用[12], 具体表现在:烷基化的细胞毒性药物, 通过减少DNA修复机制, 可以显著降低伊立替康毒性[13]; 与单一药物治疗相比, 小剂量的两种药物联合能起到显著的抗肿瘤作用[13, 14, 15]; 两药无药动学相互作用[12]; 两种药物联合应用不增强毒性 [17, 18, 19]。联合用药过程中最常见的不良反应是药物相关性腹泻、呕吐、骨髓抑制等, 给予相应处理后患者可以耐受; 未见严重的不良反应。
本研究结果发现, 伊立替康联合环磷酰胺观察组疾病控制率达77.8%明显高于对照组, 差异有统计学意义; 两组患者总有效率可能为样本量较小, 差异无统计学意义, 但从结果可以看出, 观察组总有效率55.6%高于对照组27.8%。2006年, Brian 等[20]进行的一项研究中, 伊立替康联合替莫唑胺方案用于复发或者顽固性NB的治疗, 结果表明有效率仅为8%。有效率明显较本研究观察组低, 造成这一差异的原因可能与药物使用途径及使用剂量不同有关。
晚期NB患者, 由于其肿瘤体积多较大, 常包绕原发部位周边多血管, 手术困难, 因此化疗缩小肿瘤, 获得手术机会至关重要。本研究结果显示, 观察组获得手术概率(18/18)较对照组(15/18)多, 可能样本量小, 两组间比较差异无统计学意义, 但根据临床体会, 观察组瘤体缩小程度及耐受情况均优于对照组, 能为手术治疗提供良好的时机。晚期神经母细胞瘤因预后差, 5年无病生存率仅为36%。本研究观察组PFS、OS, 1年生存率均较对照组高, 且差异有统计学意义, 关于化疗相关毒性分析中, 观察组发生血小板下降、贫血、转氨酶增高例数均较对照组少, 且差异具有统计学意义, 未出现严重心肺及肝肾功能损害。化疗引起的恶心、呕吐及腹泻均可耐受, 化疗间歇期未再出现明显恶心、呕吐, 可明显提高患者的生存质量。
综上所述, 晚期NB 5年生存率仍低, 复发率高, 而伊立替康联合环磷酰胺对晚期NB疗效好, 骨髓抑制及脏器损害作用小, 对于初发病例, 可早期使用, 一方面保证疗效, 另一方面在复发后, 保证患儿脏器功能损害小, 能耐受其他化疗及治疗方法。对于已达到手术指征, 术前出现脏器功能受损或合并其他症状需暂缓手术患者, 可行伊立替康联合环磷酰胺化疗, 延缓肿瘤进展且不造成严重骨髓抑制及脏器功能损害, 待脏器功能恢复及症状缓解后即可行手术。尽管本研究为小样本病例的回顾性研究, 且随访时间不足, 但仍可以得出结论:伊立替康联合环磷酰胺是目前治疗晚期NB的有效方法之一, 但对于其后续治疗的选择仍需今后不断地累积病例进行一定数量的临床样本对照研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|