作者简介:王星星,硕士研究生。
目的 研究甲状旁腺激素(parathyroid hormone, PTH)(1-34)、多聚赖氨酸应用于种植体表面的促成骨作用。方法 将PTH(1-34)和多聚赖氨酸通过层层自组装的方式涂层到种植体表面。按照涂层制备方法和PTH(1-34)浓度将种植体分为4个组: PLL载体组(A组)、10 μg组(B组)、100 μg组(C组)和空白对照组(D组)。使用ELISA法探索该涂层的体外药物释放规律;将小鼠胚胎成骨前体细胞MC3T3-E1接种于涂层后的种植体表面,使用MTT法、碱性磷酸酶半定量、PCR等方法,检测该涂层在体外条件下对成骨细胞生物学行为的影响。结果 通过层层自组装技术于钛种植体表面制成的PLL-PTH(1-34)聚电解质多层膜涂层在初始阶段表现出明显的释放过程,随后释放程度趋于平缓,第14天时仍可检出PTH(1-34)。MTT检测:第5 天时C组OD值(1.738±0.026)与第1天(1.663±0.045)相比有明显升高( P=0.0219)。碱性磷酸酶半定量:第14天时,C组(3.377±0.336)U/gprot明显高于A组(2.537±0.083)U/gprot、B组(2.843±0.060)U/gprot和D组(2.063±0.061)U/gprot,差异均有统计学意义( P<0.05)。PCR检测:ALP基因于第7天时各组表达水平最高,且C组明显高于A、B、D三组,差异均有统计学意义( P<0.05);OCN基因于第14天时各组表达水平最高,且C组明显高于A、B、D三组,差异均有统计学意义( P<0.05)。结论 在钛种植体表面可以通过层层自组装技术制成PLL-PTH(1-34)聚电解质多层膜涂层。通过该技术可以实现PTH(1-34)较长时间的局部释放,从而促进其表面成骨细胞的增殖和分化。
Objective To promote osteogenesis, parathyroid hormone which can promote bone formation was used to process surface of implant material.Methods Parathyroid hormone PTH (1-34) and polylysine were coated to the surface of the implant material through layer by layer self-assemble technique. ELISA was used to explore the in vitro pharmacokinetics regularity of the coating. The mouse embryos osteogenesis precursor cells MC3T3 E1 were seeded on the coated implant material surface. MTT, alkaline phosphatase semi-quantitative and PCR methods were used to detect the in vitro influence of osteoblast biology behavior.Results PLL - PTH (1-34) polyelectrolyte multilayer membrane coating made by layer by layer self-assemble technique showed significant release process in the initial phase, then the release leveled off, and PTH (1-34) could be detected until 14 d. MTT: OD value of group C (1.738±0.026) on the 5 d elevated compared with 1 d (1.663±0.045) ( P=0.0219). Alkaline phosphatase semi-quantitative: activity of alkaline phosphatase in group C (3.377±0.336) U/gprot was higher than in group A (2.537±0.083) U/gprot, B (2.843±0.060) U/gprot and D(2.063±0.061) U/gprot; the difference was statistically significant ( P<0.05). PCR: expression level of ALP in four groups were highest on 7 d, and in group C was higher than in groups A, B and D (the difference was statistically significant, P<0.05); expression level of OCN in four groups were highest on 14 d, and in group C was higher than in groups A, B and D (the difference was statistically significant, P<0.05).Conclusions PLL - PTH (1-34) polyelectrolyte multilayer membrane can be made on implant material surface through layer by layer self-assemble technique. PTH (1-34) can release for a long time (14 d) by this technique, so as to promote proliferation and differentiation of the osteoblasts seeded on the surface.
为了使口腔种植体获得理想的种植体-骨界面, 即骨结合, 从初次植入到二次手术通常需要间隔3~6个月[1]。因此, 提高种植体的成功率和早期稳定性一直是研究的热点。应用生物活性因子改善骨结合是常见的方法之一。甲状旁腺激素(parathyroid hormone, PTH)是由甲状旁腺细胞产生和分泌的一种直链多肽, 具有调节机体钙、磷代谢的重要作用, 在骨代谢中具有促进骨形成与骨吸收的双重效应:间歇应用可促进骨形成, 而持续应用会诱发骨吸收。因此, 笔者从提高种植体骨结合水平、缩短种植体骨结合形成时间的角度出发, 设计应用具有促进骨形成作用的PTH(1-34)对种植体表面进行处理, 以期在保留其生物学活性的同时, 还能具有控释的效果, 从而达到促进成骨的作用。
纯钛钛片(Ti, 99.997%, 直径10 mm, 厚1 mm, 西安宝鸡钛业有限公司), 多聚赖氨酸(polylysine, PLL)(Sigma公司), PTH(1-34)(Bachem公司), 小鼠胚胎成骨前体细胞MC3T3-E1(中国科学院细胞库), α -MEM培养液、胎牛血清、胰蛋白酶、β -甘油磷酸钠(Gibco公司), 地塞米松(上海榕柏公司), MTT检测试剂盒、碱性磷酸酶检测试剂盒(南京建成有限公司), Trizol抽提试剂盒、反转录试剂盒、荧光定量试剂盒(TakaRa公司)。
1.2.1 钛种植体表面涂层的制备 将纯钛钛片加工成1 mm厚, 直径为15 mm的圆形钛片, 共114片。依次用200#、400#、600#、800#、1200#、1500#、2000#的砂纸打磨抛光。再用丙酮和无水乙醇洗涤, 最后用蒸馏水超声清洗30 min, 室温下干燥。将干燥的钛片置于5 mol/L的NaOH溶液室温浸泡30 min, 然后再用蒸馏水超声清洗15 min, 室温下干燥。钛片按实验要求分为4组, A组(PLL载体组)27片先浸入1 mg/ml的PLL溶液20 min, 取出后用0.1 mol/L的PBS溶液冲洗3次。室温下干燥, 备用。B组(10 μ g组)和C组(100 μ g组)各30片, 首先浸入1 mg/ml的PLL溶液20 min, 取出后用0.1 mol/L的 PBS溶液冲洗3次。然后B组浸入用PBS溶液配制成的浓度为10 μ g/ml的PTH(1-34)溶液20 min, C组浸入用相同方法配制成的浓度为100 μ g/ml的PTH(1-34)溶液20 min, 取出后用0.1 mol/L PBS冲洗3次。上述步骤重复进行9次, 最后再次浸入1 mg/ml的PLL溶液20 min, 取出后用0.1 mol/L的 PBS溶液冲洗3次, 室温下干燥, 备用。D组(空白对照组)27片用作对照不再进行任何处理。
1.2.2 体外药物释放 取B组和C组各3枚试片放入细胞培养板中。每组3个副孔, 每孔注入1 ml PBS, 将24孔板置于恒温摇床内。并于第6、8、12 小时和第1、2、3、5、7、10、14天时将各副孔中的缓释液全部吸出, -80 ℃保存, 并向每孔中加入新的1 ml无菌PBS。完成最后一次样品采集后将所有样品和留存PTH(1-34)溶液解冻, 用ELISA法分析样本中PTH(1-34)的浓度, 进行数据分析。
1.2.3 细胞培养 取小鼠胚胎成骨前体细胞MC3T3-E1(中国科学院细胞库), 于37 ℃, 5%CO2饱和湿度条件下的恒温培养箱中培养, 隔天换液, 培养液为含有10%胎牛血清的α -MEM, 镜下观察细胞达90%左右进行传代培养。
1.2.4 细胞增殖检测 按1.2.1的方法获得4组钛片, 每组9块, 分为3个小组分别置于3个24孔培养板中。将MC3T3-E1细胞以4× 104个/孔接种到上述钛片上, 分别于第1、3、5 天取出一块培养板, 使用MTT法在相同的条件下培养, 吸取上清用酶联免疫检测仪在490 nm波长下测量吸光度值。
1.2.5 碱性磷酸酶半定量 按1.2.1的方法获得4组钛片, 每组9块, 分为3个小组分别置于3个24孔培养板中。另外, 取MC3T3-E1细胞按2× 104个/ml接种到培养板中, 于恒温培养箱中培养24 h, 将普通培养液换成诱导培养液(原培养液、0.01 mol/Lβ -甘油磷酸钠、50 mg/L维生素C、10-8 mol/L地塞米松), 3 d换液。于培养第4、7、14 天取出一块培养板, 检测碱性磷酸酶(alkaline phosphatase, ALP)活性。检测时按试剂说明加入细胞裂解液200 μ l, 37 ℃条件下裂解4 h, 振荡0.5 h。取150 μ l裂解液, 加入等量底物反应液, 在37 ℃条件下水浴30 min, 用酶联免疫检测仪在405 nm处测定吸光度值(D405)。再取10 μ l裂解液, 加入200 μ l蛋白分析液, 室温下震荡5 min, 酶联免疫检测仪在630 nm处测定吸光度值(D630), 于标准曲线上求得总蛋白浓度。按照ALP=D405/总蛋白浓度求得ALP值。
1.2.6 成骨基因表达 按1.2.5的方法进行细胞培养和诱导分化, 于培养的第4、7、14 天取出一块培养板。Trizol抽提细胞总 RNA, 反转录试剂盒合成 cDNA模板。扩增成骨相关基因, 用定量PCR仪获得扩增和溶解曲线以及循环阈值(cycle threshold, Ct)。用Δ Ct= Ct标本-Ctβ -action对标本基因的表达强度进行校正。以相对表达量(2-Δ Δ Ct)为检测值。
PCR所用引物序列为:
ALP:上游, 5'-GCAGGATTGACCACGGACACTA-TG-3'; 下游, 5'-TTCTGCTCATGGACGCCGTGAAGC-3'。
OCN:上游, 5'-AGGAGGGCAATAAGGTAGTGAA-3'; 下游, 5'-TACCATAGATGCGTTTGTAGGC-3'。
β -action: 上游, 5'-ATCTCCTTCTGCATCCTGTCG-3'; 下游, 5'-TGGACTTCGAGCAAGAGAGATGG-3'。
采用SAS 9.3和SPSS 18.0进行数据分析。计量数据采用的形式表示; 采用重复测量的方差分析法分析不同处理的作用及处理与时间的交互作用等, 相同处理组两时间点的差异采用配对样本t检验进行分析; 相同时间点不同处理组的比较采用方差分析, 多重比较采用LSD-t检验。P< 0.05认为差异有统计学意义。
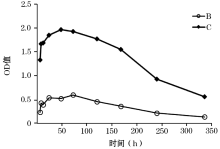
如图1所示, B组和C组释放趋势相似:均在初期(第6小时至第3天)表现出明显的释放过程, 第3天后释放量开始减少, 且到第14天时仍能检出。
处理与时间无交互作用(P=0.1016), 处理组的差异有统计学意义(F=57.99, P< 0.0001)。A组OD值第5 天与第3天相比有明显降低, 差异有统计学意义(P=0.0132); C组第5 天OD值与第1天相比有明显升高, 且差异有统计学意义(P=0.0219, 表1)。
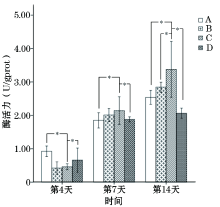
如图2所示, 随着处理时间的延长不同材料表面的碱性磷酸酶活性均表现出上升的趋势。第4天时, B组与C组间差异无统计学意义, C组低于A组和D组, 且差异均有统计学意义(P< 0.05); 第7天时, B组与C组间差异仍
无统计学意义, 但C组略高于A组和D组, 差异均有统计学意义(P< 0.05); 第14天时, C组(3.377± 0.336)U/gprot明显高于A组(2.537± 0.083)U/gprot、B组(2.843± 0.060)U/gprot和D组(2.063± 0.061)U/gprot, 差异均有统计学意义(P< 0.05)。
| 表1 成骨细胞在4组材料表面3个时间点的OD值(n=3; |
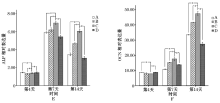
如图3A所示, ALP基因的表达水平在第4天时C组与A、B、D三组间差异均有统计学意义(P< 0.05), 且C组低于A组和D组。第7天时各组表达水平最高, 且第7天和第14天时C组均明显高于A、B、D三组, 差异均有统计学意义(P< 0.05)。OCN基因的表达水平在第4天时C组低于A组和D组。各组表达水平在第14天时最高, 且第7天和第14天时C组均明显高于A、B、D三组, 差异均有统计学意义(P< 0.05, 图3B)。
层层自组装是一种简单而有效的种植体表面改性的方法, 通过层层自组装技术可以将带相反电荷的聚电解质在种植体表面交替沉积成聚电解质多层膜, 并可以通过调节聚电解质的种类、多层膜的厚度以及多层膜中所附载的具有生物学活性的物质, 赋予种植体材料多种不同的功能。而且这种方法操作简单, 制备条件温和, 容易实施。根据对已有的文献检索尚未有将层-层自组装技术用于甲状旁腺激素对种植体表面改性应用的研究报道。
笔者利用氢氧化钠对钛种植体表面进行处理, 使其表面携带负电荷。使该材料在中性的PLL溶液中可以吸附一层带正电荷的PLL。PLL是一种亲水性的生物可降解大分子, 对生物体无不良反应, 具有良好的生物相容性, 在体内可以降解为小分子的氨基酸, 被生物体吸收。另外, PTH(1-34)在中性溶液中带负电荷, 因此, 可以实现与PLL在钛种植体材料表面的交替沉积。本研究表明在钛种植体表面通过层层自组装技术制成的PLL-PTH(1-34)聚电解质多层膜涂层在PBS溶液中初始阶段表现出明显的释放过程, 随后释放程度趋于平缓, 第14天时仍能检出。
PTH是由甲状旁腺细胞产生和分泌的, 一种具有调节机体钙、磷代谢重要作用的激素。2002年人工合成的PTH(1-34)被FDA批准应用于骨质疏松症的临床治疗 [2, 3, 4, 5, 6]。有研究发现, PTH可以在骨质疏松的情况下促进种植体骨结合[7, 8, 9, 10, 11]。但PTH具有促进骨形成和骨吸收的双重效应[12, 13, 14, 15, 16, 17]。有研究认为, PTH对骨代谢的调节作用主要取决于血清中PTH浓度高于内源性PTH基线水平的时间[18]。PTH首先在没有引起骨吸收的情况下促进骨形成[19]。随后骨重建活动增加, 并逐渐达到峰值, 但总体表现仍是促进骨形成[20], 然后PTH引起的骨量增加的效应开始衰减[21]。因此在美国PTH(1-34)的推荐总疗程不超过18个月 [22]。
在口腔种植领域有学者尝试了PTH的局部应用, 以期能够达到促进种植体骨结合的目的, 同时避免全身应用的弊端。Valderrama等[23]的研究发现含有PTH的水凝胶可以明显地促进种植体周围骨愈合。Yu等[24]将PTH掺入到钛种植体表面磷酸钙涂层中, 经体内研究发现PTH的引入可以促进种植体骨结合。因此, 我们设想用适当的方式实现PTH的局部释放, 从而在避免全身性应用的同时实现促进种植体骨结合的目的。
本研究将MC3T3-E1细胞接种于四种种植体材料(A:PLL载体组、B:10 μ g组、C:100 μ g组、D:空白对照组)表面。经MTT检测发现, 前3 d各组钛种植体表面的成骨细胞均表现出明显的增殖, 说明该涂层没有影响成骨细胞在钛种植体材料表面的早期增殖。第5天时, 当A组和D组成骨细胞增殖出现减少时B组表现不明显, 而C组则保持不变, 说明引入PTH(1-34)的涂层可以发挥其促进成骨细胞增殖的能力。通过成骨细胞碱性磷酸酶半定量分析可以发现, 在C组材料表面, 碱性磷酸酶活性从第7天开始高于A组和D组, 但与B组相比差异无统计学意义。第14天时C组则明显高于A、B、D三组, 差异有统计学意义。从成骨细胞相关基因的表达分析也可以看出引入PTH(1-34)后的B组和C组材料有助于促进成骨相关基因ALP和OCN的表达。尤其是C组第7天时ALP基因表达水平最高, 且明显高于其他三组, 差异有统计学意义。第14天时C组OCN基因表达水平最高, 且明显高于其他三组, 差异有统计学意义。因此, 可以说明引入PTH(1-34)的涂层可以发挥其促进成骨细胞分化的能力。
综上所述, 在钛种植体材料表面可以通过层层自组装技术制成PLL-PTH(1-34)聚电解质多层膜涂层。通过该技术可以实现PTH(1-34)较长时间的局部释放, 从而促进其表面成骨细胞的增殖和分化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|