目的 观察泛素连接酶9(ubiquitin conjugating enzyme 9,UBC9)在表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)作用的脂多糖(lipopolysaccharide,LPS)诱导A549细胞中的表达,探讨UBC9与EGCG抗炎性反应机制的相关性。方法 根据筛选结果随机分为对照组、EGCG组、LPS组、EGCG+LPS组4个组,MTT检测不同浓度的EGCG(50~400 μg/ml)和LPS(10~50 μg/ml)对A549细胞增殖活性的影响,筛选最佳作用浓度,进一步通过免疫组化染色法、蛋白质印迹法和Realtime-PCR检测分析各处理组UBC9蛋白及其mRNA的相对表达量。结果 MTT显示,200 μg/ml的EGCG细胞增殖抑制作用最强( F=1618.18, P<0.001),LPS 25μg/ml细胞增殖活性最明显( F=237.38, P<0.001)。免疫组化与蛋白质印迹检测均显示,与对照组比较,EGCG下调A549细胞UBC9蛋白表达( P<0.001),LPS则上调UBC9表达量( P<0.001),与LPS组比较,EGCG+LPS组UBC9蛋白表达明显降低( P<0.001)。同样,Realtime-PCR显示,与对照组比较,EGCG组UBC9 mRNA表达下调( F=89.34, P<0.001),LPS组UBC9 mRNA表达上调( F=225.00, P<0.001),与LPS组比较,EGCG+LPS组UBC9 mRNA的表达受到抑制,显著降低( F=625.00, P<0.001)。结论 EGCG下调LPS刺激的炎性反应模型的UBC9的表达,其抗炎机制可能与抑制UBC9蛋白与mRNA表达有关。
Objective To observe the effect of EGCG on the expression of UBC9 in the A549 inflammatory model, and investigate its correlation with the anti-inflammatory mechanism of EGCG.Methods A549 cells were randomly divided in vitro into four group: control group, EGCG group, LPS group, and EGCG plus LPS group. The proliferative activity of A549 cells, which were incubated with different concentrations of EGCG(50~400 μg/ml) and LPS(10 ~50 μg/ml), was detected by MTT method to select the optimum concentration for experiment. The relative expressions of UBC9 protein and mRNA in each group were determined with immunohistochemical staining, Western blot and real-time-PCR, and compared.Results MTT showed that 200 μg/ml EGCG had the strongest inhibitory effect on proliferation of A549 cells( F=16181.18, P<0.001), while 25 μg/ml LPS had the strongest promoting effect ( F=237.38, P<0.001). As observed with immunohistochemistry and Western blot, EGCG down-regulated the expression of UBC9 protein( P<0.001) while LPS up-regulated the expression( P<0.001) compared to control group. Compared to LPS group, the expression of UBC9 protein in EGCG plus LPS group was reduced significantly( P<0.001). Similarly, Real-time-PCR revealed that the expression of UBC9 mRNA decreased in EGCG group( F=89.34, P<0.001), but increased in LPS group( F=225.00, P<0.001) compared with control group. Compared to LPS group, the expression of UBC9 mRNA in EGCG plus LPS group was inhibited and reduced significantly( F=625.00, P<0.001).Conclusions EGCG can down-regulate the expression of UBC9 in the inflammatory model induced by LPS.The anti-inflammatory mechanism of EGCG might be mediated by suppression of UBC9 protein and mRNA expression.
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是绿茶提取物茶多酚的主要活性成分。脂多糖(lipopolysaccharide, LPS)是细菌内毒素的主要成分, 可刺激组织细胞增生, 激发多种炎性物质释放, 诱导炎性反应的发生。泛素连接酶9(ubiquitin conjugating enzyme 9, UBC9) 作为类泛素化修饰中的关键酶, 在肿瘤发生发展起重要作用[1], 已有研究发现UBC9在人类多种肿瘤中呈高表达[2, 3], 如乳腺癌、头颈部肿瘤、肺癌。炎性反应是导致癌症发生发展的重要因素, 被认为是癌症的第七特征[4, 5]。有研究报道, EGCG对肺癌[6]、肝癌[7]、鼻咽癌[8]、宫颈癌[9]等肿瘤细胞均有抑制作用, 但EGCG抗癌效应是否与抗炎有关以及具体机制的研究目前尚未见报道。本研究通过探讨EGCG对LPS诱导的人肺腺癌上皮细胞株A549细胞炎性反应模型的作用及是否与调节UBC9蛋白与mRNA的表达量有关, 旨在为临床癌症诊疗提供新的生物指标。
人肺腺癌上皮细胞株A549由青岛大学附属医院中心实验室提供, 1640培养液及胎牛血清为Hyclone公司产品, 大肠杆菌LPS、EGCG购自Sigma公司, 羊抗人UBC9多克隆抗体购自Sata公司, PV-9000二抗试剂盒、DAB显色试剂盒购自北京博奥森, RNA抽提试剂盒、Realtime-PCR试剂盒、cDNA合成试剂盒及SYBR Master Mixture均购自大连Takara公司。引物序列均由上海生工技术有限公司合成, 其中用于Realtime-PCR的引物具体序列(表1)。
| 表1 Realtime-PCR引物序列 |
1.2.1 细胞培养及分组 人肺腺癌上皮细胞株A549复苏后培养于含胎牛血清的10%DMEM-1640培养液中, 置于37 ℃、5% CO2培养箱中培养、扩增, 扩增3~4代后用于实验, 取指数生长期细胞稀释为7× 103个细胞接种于96孔板, 随机分组。
1.2.2 细胞活性测定实验 根据前期实验筛选的浓度进行实验, 加入不同浓度的EGCG(50~400 μ g/ml)和LPS(10~50 μ g/ml), 对照组加入相应体积的无血清DMEM-1640培养液, 每组设6个平行孔。然后, 置培养箱中培养20 h后取出96孔板, PBS冲洗3次, 加入MTT后继续置培养箱中培养4 h后倾去上清液, 加二甲基亚砜溶解, 振荡10 min, 酶标仪检测490 nm处各孔的吸光度值(A值), 筛选EGCG、LPS最佳浓度, 以用于下步实验。细胞存活率(%)=(实验组A490-空白组A490)/(对照组A490-空白组A490)× 100%。
1.2.3 免疫组化法实验 根据筛选结果作用于预先多聚赖氨酸包被的爬片, 实验分为对照组、EGCE组、LPS组和EGCG+LPS组4个组, 作用24 h后取出细胞爬片, 4%多聚甲醛溶液固定, PBS冲洗3次, 0.1% TritonX-100室温孵育15 min, 冲洗3次, 3%过氧化氢37 ℃孵育10 min, 稀释一抗UBC9(1: 50)4 ℃过夜, 生物素标记的二抗(1: 100)依次37 ℃孵育30 min和150 min, PBS充分冲洗, 染色、复染、脱水、封片。以细胞内呈现黄色或棕褐色颗粒为阳性反应, 随机计数200个细胞, Image-pro Plus软件分析阳性信号强度。
1.2.4 蛋白印迹法检测实验 加入不同实验因素, 作用24 h后收集各组的A549细胞, 加入RIPA蛋白裂解液, 提取样本蛋白, BAC法定量蛋白, 制备SDS-PAGE胶, 常规电泳, 转膜, 封闭, 一抗(NF-κ B 1: 500, iNOS 1: 200, UBC9 1: 1000)孵育4 ℃过夜, 二抗(1: 5000)室温孵育2 h, 显色剂(1: 1)显色, Lane1D凝胶分析软件分析, 设未处理的细胞作为对照组, 以GAPDH作为内参。
1.2.5 细胞UBC9 mRNA相对表达量测定 Trizol法提取总RNA, 取1 μ l的反应体系分光光度计测定RNA纯度(OD260/280介于1.8~2.0)。采用Takara反转录试剂盒反转录, 根据总RNA浓度计算体积, 参照Takara说明书扩增, 目的基因与内参都是95 ℃预变性30 s, 95 ℃变性30 s, 60 ℃退火30 s, 共35个循环。制定标准曲线, 根据标准曲线公式计算样本的拷贝数。
采用SPSS17.0统计软件进行数据分析。计量数据以
不同浓度的EGCG(50~400 μ g/ml)作用于A549细胞24h后, 均显示了对A549细胞增殖活性的抑制, 组间两两比较进一步显示200 μ g/ml浓度的EGCG抑制细胞增殖活性作用更强(F=1618.18, P< 0.001, 图1A)。各浓度组LPS(10~50 μ g/ml)则均可促进细胞的增殖活性, 其中25 μ g/ml浓度LPS的增殖促进作用最为明显(F=237.38, P< 0.001, 图1B)。以25 μ g/ml为LPS刺激浓度, 200 μ g/ml为EGCG干预浓度。
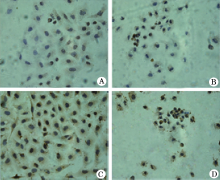
2.2.1 免疫组化法 染色与蛋白信号强度检测显示, 与对照组(图2A)比较, EGCG使细胞变圆, 细胞质皱缩, 胞核固缩, UBC9蛋白表达下调(图2B, F=1022.42, P< 0.001), LPS则促进细胞增殖, 可见细胞数量增多、细胞质与核着色加深, 蛋白表达上调(图2 C, F=717.89, P< 0.001)。与LPS组比较, 加入EGCG的干预组细胞数量明显减少, 细胞变小变园, 胞质萎缩, 胞核固缩, UBC9蛋白表达量显著下降(图2D, F=664.31, P< 0.001)。其中, UBC9蛋白在各组细胞细胞核、细胞质的表达量与对比关系见图3。
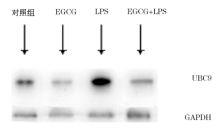
2.2.2 蛋白印迹法 以GAPDH为标准对照, 印迹带初步显示了UBC9蛋白在各个实验组的表达情况, LPS上调UBC9蛋白在A549细胞中的表达水平, EGCG下调A549细胞及LPS诱导的A549细胞中UBC9蛋白的表达量(图4)。蛋白定量软件灰度值分析显示(图5), 与对照组比较, LPS、EGCG分别上调、下调UBC9蛋白在A549细胞中的表达(F1=7150.26, F2=6079.35, P< 0.001), EGCG显示了对LPS刺激的A549细胞的调节作用, 与LPS组比较, EGCG干预下调LPS诱导的A549细胞的UBC9蛋白表达量(F=1270.26, P< 0.001)。
肺癌作为最常见的恶性肿瘤, 发病率高, 生存率低, 预后不良, 是一种严重威胁人类健康的恶性疾病。研究表明, 炎性反应与肺癌的发生、发展及预后都有密切的关系, 是肺癌发生发展的重要驱动因素, 探讨抗炎机制, 寻找早期诊断标志物对深化肺癌发病机制的认识、指导临床诊治和评价预后具有重要意义[10, 11]。
LPS是革兰阴性菌细胞壁的主要成分, 是一种强烈的炎性反应诱导剂。茶多酚是从绿茶中提取出来的多酚类化合物, EGCG为茶多酚的主要组成成分, 亦是其最重要的活性成分, 多项研究报道了EGCG的抗肿瘤效应[12, 13]。文献[14, 15]发现, EGCG能够明显抑制LPS诱导的炎性反应过程。近年来, 炎癌分子机制的研究已成为癌变研究领域关注的焦点, 类泛素化修饰(SUMO化修饰)是一种蛋白质翻译后修饰, 在细胞周期调控、转录调控、核质转运、蛋白质相互作用、DNA修复及维持基因组稳定性等方面扮演重要角色[16], 其过程中的重要因子在许多肿瘤组织中表达异常[17], 被认为可能是肿瘤发生发展的关键分子机制。UBC9作为类泛素化修饰中的关键酶, 广泛地表达于人类诸多器官和组织, 介导细胞功能调节与实现, 已有研究发现UBC9在包括肺癌在内的多种肿瘤中呈现高表达[17, 18]。
本研究通过观察EGCG、LPS作用的人肺腺癌上皮A549细胞及EGCG作用的LPS刺激A549细胞中UBC9蛋白与mRNA的表达量, 探讨EGCG对LPS刺激的A549细胞炎性反应模型的调节作用及其机制是否与调节UBC9蛋白与mRNA的表达量有关。本研究MTT显示, 不同实验浓度的EGCG均能够抑制A549细胞的增殖活性, 而不同实验浓度的LPS则都能够促进A549细胞的增殖, 其中200 μ g/ml的EGCG抑制效应最明显, 25 μ g/ml的LPS促进效应最显著, 为最佳作用浓度。进一步的免疫组化学染色显示, EGCG作用的A549细胞形态发生改变, 细胞体积变小, 胞质浓缩, 核固缩, 部分染色质呈现高度浓缩, 脱落、聚集于核中央部的致密核, 可呈花瓣状或环状; 而LPS作用的A549细胞, 细胞密度增大, 细胞体积变大, 细胞质、细胞核染色变深, 加入EGCG干预后细胞数量明显减少, 细胞变小变园, 胞质萎缩, 胞核固缩。量化分析显示, UBC9蛋白表达与Realtime-PCR检测结果一致, LPS上调A549细胞UBC9蛋白与 mRNA的表达, EGCG则下调UBC9蛋白与mRNA的表达(P< 0.01), EGCG对LPS刺激的A549细胞炎性反应模型的UBC9蛋白与mRNA表达有抑制作用(P< 0.01)。LPS诱导炎性反应, 促进细胞增殖的作用机制涉及到受体识别、信号转导、蛋白修饰、因子释放等过程, 本研究发现LPS诱导的A549细胞炎性增殖模型中UBC9蛋白及其mRNA表达量显著增加, 提示UBC9可能是肺癌细胞增殖的重要活性分子。EGCG可抑制LPS刺激的A549细胞的增殖活性, 本研究结果与文献[14, 15]报道一致。同时, 本研究证实LPS刺激的A549细胞施予EGCG干预后, 增殖抑制的同时, UBC9蛋白与mRNA表达明显下调, 进一步表明UBC9可能在癌细胞炎性反应增殖过程中扮演重要角色, 且构成EGCG调节干预的关键靶点。由此, 初步推测EGCG对LPS诱导的A549细胞炎性反应的抑制, 作用可能与调节UBC9蛋白及其mRNA表达有关。这一研究发现为通过抗炎机制防治肺癌的研究拓展了新的思路和线索, 通过更深入的探讨, 检测和干预UBC9有望成为肺癌临床诊疗的新的指征和策略。
综上所述, 由于本研究缺乏封闭或过表达UBC9的数据, EGCG抗炎机制与抑制UBC9间的逻辑联系尚不充分, 这种相关性推测外延的拓展需要开展进一步的实证研究, 克服细胞体外实验自身的局限性, 基于标准的炎性反应动物模型, 系统观察EGCG对UBC9表达和癌细胞在体转归的影响, 特别是对慢性低剂量炎-癌模型UBC9变化及其癌症转归相关性观察, 从而夯实研究结论可靠性和科学性的数据基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|