孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是一种间叶组织来源的梭形细胞肿瘤, 由 Klemperer 和Robin 1931 年首次提出[1]。最初认为起源于胸膜间皮细胞, 后来随着认识的深入, 证实了 SFT起源于CD34+的树突状间叶细胞, 具有向纤维母细胞、 肌纤维母细胞、 血管外皮细胞及血管内皮细胞分化的特性[2]。SFT可发生在任何年龄段, 其中以中老年人多见, 发病无性别差异, 大部分SFT 为良性, 表现为生长缓慢的无痛性包块, 有12%~22%为恶性[3]。SFT主要发生于脏层胸膜, 腹腔及腹膜后罕见。近期我院收治腹膜后恶性孤立性纤维瘤(malignant solitary fibrous tumor, MSFT)3例。
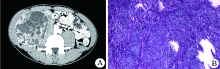
例1, 男性, 64岁, 主因“ 腹部肿物伴间断性全身出冷汗1周” 于2015-07-02入院。既往病史: 2011年因发现腹部肿物2年, 伴腹部疼痛不适1周入院, 完善检查后行腹膜后肿瘤切除术, 术后病理回报:梭形细胞肿瘤, 符合恶性孤立性纤维性肿瘤; 于2015年因“ 间断性全身出冷汗、躁动1个月余” 入院, 入院前曾有低血糖昏迷, 给予静脉补充高糖后缓解。腹部CT提示:腹膜后巨大肿物, 诊断为恶性孤立性纤维性肿瘤, 伴低血糖。行腹膜后肿物切除术, 术后未见低血糖发作。术后病理:腹膜后梭形细胞肿瘤, 免疫组化结果显示:BCL2(+), CD34(-), CD99(+), S-100(-), Vimentin(+), 结合病史符合MSFT复发。本次入院体格检查:左上腹部可触及巨大包块, 直径约10 cm, 境界不清, 活动小, 无压痛。腹部CT:腹膜后多发肿物影, 大者位于十二指肠水平, 直径约10 cm, 平扫期肿物呈低密度, 增强扫描可见不均匀强化(图1A、B)。肿瘤标志物化验均在正常范围内。入院诊断为恶性孤立性纤维性肿瘤, 伴低血糖。于2016-07-06行手术治疗, 术中探查可见:腹腔内可见大小不等肿瘤, 小的约米粒大小, 大的约拳头大小, 左上腹可触及巨大瘤体, 约10 cm× 10 cm× 8 cm瘤体, 瘤体血供丰富, 血管明显增粗。手术行多发肿瘤切除。术后监测患者血糖, 未见低血糖症状。术后病理:送检标本:送检灰红附包膜结节数枚, 包膜完整, 总大小25 cm× 18 cm× 9.5 cm, 最小者1 cm× 0.8 cm× 0.5 cm, 切面灰红实性质中, 最大者9 cm× 8.5 cm× 8 cm, 部分切面灰红灰黄实性质中鱼肉样, 部分囊实性, 囊腔内附少量灰褐色黏液组织。印象:梭形细胞肿瘤伴坏死, 细胞异型性明显, 易见核分裂像, 免疫组化结果显示:BCL2(+), CD34(血管+), CD99(+), CK(-), Ki-67(+20%), S-100(-), Vimentin(+), CD31(血管+), 结合病史, 符合恶性孤立性纤维性肿瘤(图1C)。
 | 图1 MSFT病例1病理和CT A.腹部CT扫描可见腹膜后多发肿物影, 最大者位于十二指肠水平, CT值约30 HU; B.CT增强扫描, 肿瘤内可见低密度, 提示液化坏死; C.病理镜下(HE, × 40):肿瘤由排列致密的梭形细胞构成 |
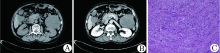
例2, 男性, 20岁, 主因“ 间断性右下腹疼痛1月余” 于2016-03-30入院。查体:右下腹可触及一直径约10 cm肿物, 边界不清, 活动度差, 无压痛。腹部CT增强扫描示:右侧腰大肌外侧见巨大囊实性肿物影, 大小约10.6 cm× 10.4 cm, 边界欠清, 密度不均, CT值约36 HU, 增强扫描不均匀强化, CT值约96 HU, 其内见多发血管影, 腰大肌形态失常(图2A)。印象:右侧腰大肌外侧占位性病变, 考虑:(1)间质来源; (2)神经源性肿瘤。肿瘤标志物(CA125、CEA、CA72-4、CA199、AFP、FERR)化验均未见异常。于2016-4-18行手术治疗, 术中探查: 腹膜后可见巨大肿瘤, 境界不清楚, 瘤体将右半结肠推向前方, 肝脏明显上移。行腹膜后巨大肿瘤切除术。送检参数:送检灰红结节样组织一枚, 大小12 cm× 10.5 cm× 6.5 cm, 局部附包膜, 局部表面见包膜破溃, 可见凝血, 切面呈囊性, 内容灰白灰红色软组织, 质软。病理回报:(腹膜后)梭形细胞肿瘤, 免疫组化结果显示: BCL2(局灶+), CD31(小血管+), CD34(散在+), CD56(+), CD68(个别+), CD99(+), CK(-), Ki-67(+15-20%), S-100(-), Vimentin(+), 考虑为腹膜后低度恶性的孤立性纤维瘤(图2B)。术后3个月局部复发。
例3, 女性, 64岁, 于2016-06-16主因“ 上腹部胀痛5个月余, 加重伴恶心、呕吐2周” 入院。查体:剑突下偏左可触及一直径约10cm肿物, 质硬, 边界不清, 活动度差, 无压痛。腹部增强CT示:左侧腹膜后可见多个不规则软组织肿物影, 病灶横截面大者为9.4 cm× 9.3 cm, 增强扫描后不均匀强化, 周围脂肪间隙模糊, 于左肾分界尚清; 左肾边缘可见高低混杂密度影, 边界不清, 密度不均, 于左肾分界不清, 左侧肾上腺显示不清(图3A、B)。印象:腹膜后占位, 考虑为间叶组织来源。肿瘤标志物化验均未见异常。2016-06-22行手术治疗:腹腔后见巨大瘤体, 将小肠、结肠脾区肠系膜及脾脏推向右上, 瘤体呈多个结节融合、左肾被多个瘤体挤压包裹, 瘤体直径大小约15 cm, 行腹膜后巨大肿物切除术。2016-07-01病理回报:(腹膜后)间叶来源肿瘤, 免疫组化结果显示: Actin(+), CD117(-), CD20(-), CD34(+), CK(-), Ki-67(+30%), S-100(-), Vimentin(+), BCL2(+), 倾向于恶性孤立性纤维性肿瘤(图3C)。
SFT是一种较为少见的梭形细胞肿瘤, 病理类型特殊, 发病率较低 [4]。查阅国内外文献, 国内关于SFT报道共344篇, 其中MSFT 43篇[5]。SFT有发生于身体多个部位的报道, 如胸膜、头颈部、颅内[6]、甲状腺、肝脏、胃、肾脏、肾上腺、子宫、眼眶及肠系膜等。临床表现可因肿瘤发生位置及大小而不同, 大多数以无痛性肿块为首发症状, 当肿块逐渐增大累及重要脏器时可出现相应症状。如发生于中枢神经系统, 会出现头晕、恶心、呕吐等症状。当肿物占据腹腔, 压迫胃肠时, 可出现呕吐、梗阻等症状, 部分患者表现以低血糖为首发症状的Doege-Potter综合征。本组3例均为腹膜后SFT, 其中2例以肿瘤增长致腹部不适及压迫症状入院, 另有1例2次伴有Doege-Potter综合征。
Doege-Potter综合征由Doege-Potter于1930年首次发现并报告, 是由SFT引起的伴瘤综合征, 肿瘤分泌胰岛素类似物, 导致低血糖症状发生[7]。5%的SFT可伴有Doege-Potter综合征, 临床表现低血糖症状。目前认为SFT导致低血糖的最主要原因为肿瘤自身分泌胰岛素类似物生长因子2( IGF-2), 致机体与IGF-2结合的蛋白质相对减少, 游离的IGF-2增多, IGF-2与胰岛素受体、IGF-1受体结合并将其激活, 使肿瘤及周围组织对葡萄糖利用增强, 同时抑制生长激素的释放, 使生长激素的拮抗低血糖的作用减弱, 最终导致低血糖症[8]。例1, 因术前未行IGF-2监测, 结合文献考虑:低血糖症状的产生原因主要与肿瘤多发, 肿瘤本身分泌IGF-2, 及体积过大的肿瘤本身消耗葡萄糖有关。行肿瘤切除术后, 术后监测血糖恢复正常。且在一段较长时间内未见低血糖症, 至再次发现低血糖症状时, 复查腹部CT可见肿瘤复发, 说明肿瘤与低血糖症状相关。但本组3例恶性肿瘤, 直径均大于10 cm, 只有1例出现低血糖症状, 考虑低血糖症状的发生主要是于肿瘤本身产生IGF-2有关, 单纯较大的肿瘤消耗葡萄糖致低血糖的机会较小。
本病影像学有一定的特点。CT多表现为边界清楚的软组织肿物, 部分呈分叶征象, 增强扫描瘤内可见囊性变、坏死及钙化[9]。多数SFT为富血流肿瘤, 多呈地图样强化, 增强扫描可见多种强化方式:早期中重度强化和持续强化方式。MRI的典型表现为T2WI呈现肿瘤内部散在片状或结节状低密度[10]。本组病例术前均行腹部CT检查, 其中1例单发肿物, 2例为多发, 其中1例为呈分叶状, 相互融合。3例病例肿瘤体积均较大, 最大径> 10 cm; CT平扫期扫描病灶呈肌肉样密度, 表现为类圆形低密度影, 增强扫描可见其内有囊性及坏死改变, 1例表现出动脉期轻度强化伴延时强化, 3例病灶增强后均呈不均匀强化, 其内可见点状及片状钙化, 周边及肿瘤内可见血管影。3例影像学均显示恶性肿瘤特征:3例均见明显的侵袭及转移特征:病例1可见多发种植, 转移; 病例2、3肿瘤分别侵及腰大肌、左肾脏。另外, SFT影像学上需与腹膜后神经源性肿瘤、脂肪瘤、淋巴瘤鉴别。神经源性肿瘤CT表现多为以等密度为主的混杂信号影, 增强扫描后可见不均匀强化, 并可见粗大钙化; 易向大血管及周围组织侵犯; 常伴淋巴结转移。脂肪瘤一般体积较大, 有包膜, 与周围组织挤压致边界不清, 密度一般为-20 HU, 增强扫面见不均匀强化。淋巴瘤一般为少血流肿瘤, 增强扫描多为轻-中度延时增强, 且伴非引流区淋巴结异常肿大为特点。
病理和免疫组织化学是确诊SFT的重要证据。镜下SFT表现为梭形, 肿瘤细胞呈束状、血管外皮瘤样或不规则排列, 细胞丰富区域和细胞稀疏区域相间分布, 间质内可见粗大的胶原纤维, 细胞壁玻璃样变性[11]。根据2006年WHO软组织肿瘤病理学分类关于 MSFT的推荐诊断标准, 恶性肿瘤表现:(1)细胞生长活跃, 密集分布; (2)细胞多形性; (3)核分裂像≥ 4/10HPF; (4)肿瘤性坏死。此外, 肿瘤广泛浸润也是诊断恶性的重要依据[12]。SFT免疫学特点表现为CD34、BCL-2、CD99、Vimentin阳性表达。本组3例镜下观细胞生长活跃, 呈梭形细胞生长, 并易见核分裂现象, 核分裂> 4/10 HPF, 免疫组化显示3例CD34、Vimentin 、BCL-2均阳性表达, CD99阳性在2例中阳性表达。另外, S-100可用于与其他软组织肿瘤鉴别, 本组3例S-100均呈阴性表达。本组病例满足具有典型MSFT形态特点, 细胞密集, 有异型性, 核分裂多见, 且病例1肿瘤内可见坏死, 3例均诊断为MSFT, 且于临床表现及影像学中肿瘤表现出的侵袭性相符合。
目前对于SFT最好的治疗的手段是肿瘤完整切除, 几乎所有的良性SFT及约50%MSFT可痊愈[13]。但SFT形态学尚不能完全提示预后, 一些形态学提示良性SFT者也有复发或转移, 因此长期随访是必要的。如果肿瘤无法完整切除, 则预后极差。本组3例肿瘤由于体积大, 侵犯范围广, 无法完整切除, 于6个月内复发。有1例多次复发入院, 且复发间隔缩短, 出现多发种植, 脾脏及双肺转移, 没有有效的化疗和放疗, 预后不好。虽然有文献报告对于MSFT可行完整切除+术后放疗可获得良好效果[14], 但目前尚无大样本数据可供参考。
总之, 对于腹膜后肿物, 或低血糖症状起病, CT表现为边界清楚的低密度, 增强扫描可见早期及延持续强化, 周边可见多发血管影, 应考虑SFT的可能。确诊需病理及免疫组化, 手术应完整切除。MSFT容易复发, 术后需长期随诊。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|