作者简介:孙 伟,博士,主任医师,教授,博士生导师。
癫 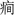
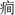

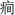
大脑是生物体内结构和功能最复杂的器官, 同时它也是极为精巧和完善的信息处理系统。10年前, 学者们提出了“ 脑网络” 的概念。“ 脑网络” 主要基于实验测量的反映大脑结构性连接的数据, 或大脑功能性连接的数据, 计算预先定义的脑区或节点的连接关系, 然后构建网络进行分析, 这是目前应用最多的一类“ 脑网络” 研究方法。
近年来, 越来越多的研究证实, JME患者的脑结构网络和功能网络(包括静息态网络和认知网络等)连接均受到了影响。下面笔者通过对JME相关网络的结构连接及功能连接方面的研究做进一步的综述, 以期对近年来JME网络连接进展有更深入的了解。
常规磁共振成像(magnetic resonance imaging, MRI)和CT(computered tomography, CT)检查通常不能发现JME患者大脑结构上微小的变化。近年来, 随着影像学技术的发展, 许多学者通过基于体素形态学分析(voxel-based morphometry, VBM)和弥散张量成像(diffusion tensor imaging, DTI)等技术发现了JME患者大脑的局部结构异常, 且异常部位主要集中在额叶结构。VBM是一种基于体素的针对脑组织结构的形态学测量方法, 它通过计算磁共振成像(主要是高分辨率的结构扫描图像)中脑的灰质/白质的变化, 以定量分析不同群体脑结构的特征和脑组织成分的差异, 从而替代了传统上人工勾画感兴趣区域的方法, 提高了测量的准确性和可重复性, 能够准确、全面评价不同群体脑的神经解剖变化。1999年, Woermann等[12]应用VBM方法首先发现额中回灰质密度发生变化, 为JME患者脑局部结构变化提供了依据。Pulsipher等[13]发现, JME患者的丘脑和额叶体积变小。Tae和Betting等[14, 15]应用VBM证实了JME患者额叶灰质密度的减少。Kim等[16]发现, JME患者丘脑灰质密度与病程呈负相关关系, 并提出JME患者可能有丘脑进行性神经元缺失。
JME患者不仅存在某些微小脑结构的异常, 其结构连接也存在一定程度的改变。DTI技术的成像原理是利用水分子扩散的各向异性进行成像, 通过测量水分子在各个体素之间运动的扩散性(平均弥散率)和运动的方向性(各向异性分数)来说明神经组织的完整性及传导性。平均弥散率(mean eiffusivity, MD)上升说明神经细胞外间隙的扩大, 而各向异性分数(fractional anisotropy, FA)的下降说明了神经组织的完整性下降, 间接说明所测神经组织存在损害。Lin等[17]发现, JME患者的辅助运动区(supplementary motor area, SMA)灰质体积减少。Deppe等[18]应用DTI技术发现, JME患者额叶白质FA降低, 反映了其纤维束可能受到了一定程度的破坏。Vulliemoz等[19]应用DTI方法对JME患者、额叶癫 
癫 

功能连接表现为大脑皮质中不同神经元(集群)完成认知任务或在静息状态下的协调反应机制。癫 
除了上述提到的应用较多的VBM、DTI及fMRI手段外, 学者们还通过磁共振波谱成像(magnetic resonance spectroscopy, MRS), 正电子发射断层显像(positron emission tomography, PET)及经颅磁刺激(transcranial magnetic stimulation, TMS)等技术研究JME患者的脑网络连接变化。Lin等[30]通过MRS发现额中前皮质、初级运动区以及丘脑N-乙酰天门冬氨酸与肌酐的比值(神经元受损的标志)下降; 额中前皮层、初级运动区及后扣带回皮质谷氨酸/谷氨酰胺与肌酐的比值减低, 说明了广泛的大脑皮质兴奋性降低。Swartz等[31]通过PET发现背外侧前额皮质、运动前区的氟代脱氧葡萄糖减少。同样, 利用PET技术, Meschaks等[32]发现JME患者中缝核、海马、背外侧前额皮质的5-羟色胺受体减少。Akgun等[33]通过TMS证实JME患者的运动区皮质兴奋性增加。国内侯文生等[34]也运用同样的方法证实了该结论。
综上所述, JME是一种发病率较高的特发性全面性癫 
在过去的20年里, JME的研究主要是本病的遗传病因学, 神经影像学和神经心理特征。然而, 这些研究结果并不能完全解释JME异常的神经机制。最近, 在网络层面上提供了触发癫 
回望人类对于癫 

The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|

