作者简介:王艳华,博士后,副主任医师。
目的 研究嗅鞘细胞(olfactory ensheathing cells, OECs )移植与α晶体蛋白联合对大鼠视神经损伤后视功能恢复的促进作用。方法 玻璃体腔α晶体蛋白注射,联合视神经损伤近端移植OECs,分为4个实验组,包括α晶体蛋白注射组、OECs移植组、α晶体蛋白注射+OECs移植组、PBS对照组。于视神经损伤并移植OECs+玻璃体腔注射药物后即刻、1周、2周、1个月、2个月、3个月,用全自动眼电生理仪进行闪烁视觉诱发电位(flash-elicited visual-evoked potential,FVEP)检测,分析比较各时间点各组P1波的振幅及潜时。结果 OECs移植组及α晶体蛋白注射+OECs移植组FVEP的P1波振幅于视神经损伤后1周[(8.49±1.19)μv, (9.33±2.54)μv]、2周[(8.85±1.92)μv,(9.43±2.41)μv]、1个月[(8.46±1.09)μv,(8.72±1.91)μv]、2个月[(8.12±1.41)μv,(8.48±1.67)μv]、3个月[(7.68±2.56)μv,(8.08±1.47)μv],均显著高于对照组( P<0.01),二者联合组P1波振幅恢复更为明显。3个实验组FVEP的P1波潜时与对照组比较,均无统计学差异。结论 OECs移植与α晶体蛋白均明显促进视神经损伤后FVEP电生理的恢复,其中,二者联合的作用最为明显。
Objective To investigate the synergistic effect of olfactory ensheating cells (OECs) and α-crystallin on visual function recovery of nerve injury in adult rats.Methods α-crystallin was injected into the vitreous cavity, and OECs were transplanted to the area of optic nerve injury. The function of optic nerves was assessed by flash-elicited visual-evoked potential(FVEP) at 1 and 2 weeks, 1 and 3 months, and immediately after OECs transplantation and α-crystallin injection.Results Compared to PBS, OECs, the combination of OECs and α-crystallin promoted the recovery of the amplitude of P1 wave at 1 week [(8.49±1.19)μv, (9.33±2.54)μv], 2 weeks [(8.85±1.92)μv,(9.43±2.41)μv],1 month [(8.46±1.09)μv,(8.72±1.91)μv], 2 months [(8.12±1.41)μv,(8.48±1.67)μv] and 3 months [(7.68±2.56)μv,(8.08±1.47)μv] after optic nerve injury (
嗅鞘细胞(olfactory ensheathing cells, OECs)及其伴随的嗅神经纤维细胞(olfactory nerve fibroblasts, ONFs)移植, 可明显促进脊髓及视神经损伤后神经的再生[1, 2], 但是视网膜神经节细胞(Retinal ganglion cells, RGCs)的神经纤维离开移植的OECs/ONFs形成的“ 髓鞘样” 通道后, 难以继续再生, 更不能实现长距离再生到达视中枢[2]。玻璃体腔注射α 晶体蛋白, 也能促进视神经损伤后RGCs存活和轴突再生[3, 4, 5], 但是在视神经损伤后1个月促进再生作用基本消失[3]。笔者前期的研究发现, OECs移植联合α 晶体蛋白能更有效地促进视神经再生[6], 但对视功能的修复尚缺乏研究。本实验通过大鼠视神经损伤后FVEP检测, 研究OECs移植联合α 晶体蛋白对视神经损伤后视功能的修复作用, 进而为神经损伤和再生的基础研究提供理论依据。
成年(250~300 g)Long Evans大鼠, 雌雄不限。由第三军医大学实验动物中心提供, 符合国家医用动物使用标准, 标准号为清洁级, 检证字SCXK(渝)20020003。
参照文献[7]进行OECs/ONFs培养。取成年Long Evans大鼠(体重250~300 g)断颈处死, 取出嗅球, 取嗅神经层和外颗粒层用0.125%胰酶消化15 min, 37 ℃。用含10%胎牛血清的DMEM/F12培养液终止消化, 加入0.5%DNAse, 吸管吹打10次后, 1000 r/min, 离心5 min。弃上清, 加入含10%胎牛血清的DMEM/F12培养液, 轻轻吹打成单细胞悬液, 接种至L-多聚赖氨酸包被的6孔培养板中, 37 ℃恒温培养箱培养。第5天首次换液, 余每3 d换液。培养第14天, 细胞密度达1.5× 106。参照文献[6, 8]分别用兔抗大鼠S-100单抗 (1∶ 200, Sigma, 美国)鉴定OECs, 小鼠抗大鼠纤维连接蛋白鉴定ONFs(1∶ 200, Santa Cruz Biotechnology, 美国)。二抗为山羊抗小鼠IgG-FITC和山羊抗兔IgG-cy3 (Boster, 中国)。
参照文献[4]进行视神经夹伤及注射。每组6只, 共24只实验大鼠用10%水合氯醛(0.4 ml/100 g)腹腔注射麻醉, 固定于手术台, 手术显微镜下剪开大鼠手术眼上穹隆结膜约120° , 避开涡静脉, 钝性分离暴露视神经, 在眼球后1 mm处, 用11号尖刀沿视神经纵轴方向纵行挑开视神经鞘膜长4~5 mm, 避免损伤视神经, 用中号无创血管夹在球后2 mm处钳夹视神经10 s, 钳夹伤后即刻, 在夹伤近端, 用35 G的NF35BV-2针头垂直视神经注射OECs(浓度1× 106/ml)单细胞悬液或0.01 M的PBS, 注射量3 μ l, 注射速度要缓慢, 约40 s注完, 注射结束后, 留针2 min再拔针。术后载玻片轻压角膜, 镜下观察眼底, 无缺血者纳入实验。α 晶体蛋白(10-4 g/L, 5 μ l)或PBS(0.01 M, 5 μ l)用10μ l的微量进样器于距离视乳头约2 mm的巩膜壁上, 垂直于视神经纵轴刺入玻璃体腔。术毕分层缝合。术后大鼠术眼涂托百士眼膏, 送西南医院动物所饲养。实验分为4组:(1)OECs移植+α 晶体蛋白注射组; (2)OECs移植组; (3)α 晶体蛋白注射组; (4)PBS对照组。
于视神经损伤前、视神经损伤并移植OECs+玻璃体腔注射药物后即刻、1周、2周、1个月、2个月、3个月进行FVEP检测。电生理检查参照临床视觉电生理标准[9], 大鼠用10%水合氯醛(0.4 ml/100 g)腹腔注射麻醉, 安放电极(记录电极置于枕后隆凸皮下, 参考电极置于双眼连线中点皮下, 接地电极置于鼠尾皮下), 暗适应5 min, 采用全视野刺激球白色闪光刺激, 记录FVEP。应用RETI-port 软件测量潜伏期和幅值。每组6只大鼠, 共24只大鼠。
应用SPSS13. 0统计软件, 计量资料以
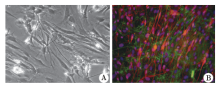
培养的细胞主要由S100阳性的细胞和fibronectin阳性的细胞构成。S100阳性的细胞呈梭形, 或三角形, 称其为雪旺样细胞; 而fibronectin阳性细胞为扁平, 不规则形, 称其为星形样细胞, 两者相互交错混合生长, 无明显分界。培养2周时, 两者之间的数目比例约为1∶ 1(图1)。
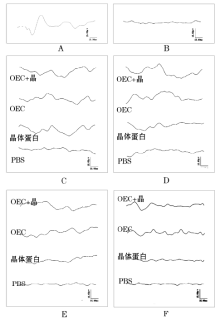
手术前, 大鼠FVEP可见明显稳定的P1波(图2A)。视神经损伤同时进行OECs损伤局部移植及α 晶体蛋白注射后, P1波变得低平, 潜时延迟(图2B, 表1)。术后7 d、14 d, OECs、α 晶体蛋白及二者联合组P1波振幅明显恢复(P< 0.01), 而对照组无明显恢复(图2C、D, 表1)。术后1个月, 3个实验组P1波振幅较损伤14 d有所下降, 但与对照组相比仍有统计学差异(P< 0.05) (图2E, 表1)。术后3个月, 3个实验组P1波振幅进一步降低, 特别是α 晶体蛋白组P1波振幅下降更为明显, 与对照组比较, 差异无统计学意义, 但OECs组及二者联合组与对照组相比仍有统计学差异(P< 0.01) (图2F, 表1)。术后各时间点, 3个实验组P1波潜时较术前均明显延迟, 且与对照组比较, 差异均无统计学意义(P> 0.05, 表1)。
| 表1 大鼠视神经损伤后不同时间各组P1波振幅及潜伏期比较( |
OECs是嗅觉系统中特殊的胶质细胞, 可分泌神经生长因子、脑源性神经营养因子、胶质细胞源性生长因子、睫状神经营养因子等多种营养因子[10], 对众多中枢神经元及RGCs具有保护和促进神经再生的作用, 为治疗脊髓和视神经的损伤提供了新的希望[2, 10, 11, 12]。虽然与脊髓损伤一样, 视神经损伤局部OECs/ONFs移植同样使胶质发生重朔, 并形成“ 髓鞘样” 通道, 保护神经再生到损伤远端, 但是与脊髓损伤所不同的是, 再生的RGCs轴突在离开OECs形成的“ 髓鞘样” 通道进入损伤远端后, 末端形成囊样膨大而不能到达靶中枢[2], 说明单纯OECs/ONFs移植存在局限性。具有热休克蛋白功能的α 晶体蛋白, 不仅能保护视网膜色素上皮细胞、光感受器细胞及晶体上皮细胞的存活[13, 14]; 而且对视神经损伤后RGCs的存活也具有显著的保护作用, RGCs存活率在视神经损伤后14 d可达95%[5]。此外, α 晶体蛋白还具有明显的促进视神经再生的作用, 玻璃体腔注射α 晶体蛋白后, 再生的轴突数比注射牛血清白蛋白组显著增多, 且这一作用持续到视神经损伤后4周[3]。其机制是通过抑制轴突再生抑制物信号传导的共同作用点— — RhoA的激活, 干扰RhoA/Rock信号通路、防止生长锥的萎缩而促进轴突再生[4]。虽然α 晶体蛋白能保护RGCs存活, 并促进轴突再生, 但在视神经损伤后4周其作用明显减弱, 并且再生轴突只达到损伤区远端5 mm, 没有实现长距离再生[3], 说明单纯应用α 晶体蛋白也存在局限性。笔者最近的研究已证明, OECs移植联合α 晶体蛋白能更有效的促进视神经再生[6], 但对视功能的修复尚缺乏研究。本实验通过大鼠视神经损伤后FVEP检测, 研究OECs移植联合α 晶体蛋白对视神经损伤后视功能的修复作用。
FVEP 是视网膜受到闪光刺激后产生的视觉电生理活动, 反映RGCs至视皮层的信息传递及视皮层的电生理活动。主要以P1波的潜伏期及振幅为分析依据, 潜伏期反映视神经髓鞘功能, 视神经损伤时, 发生脱髓鞘改变, 传导速度明显减慢, 表现为潜伏期延迟。振幅主要反映视神经视网膜接受光刺激的功能, 并与靶中枢形成突触的数目有关, 视神经损伤时, 神经束内压力增高, 神经纤维水肿, 轴索传递视觉信息及运输营养因子的功能降低, 表现为振幅降低[15, 16]。通过FVEP检测视功能情况, 具有客观、无损伤、灵敏性好的特点。Sabel[17]研究结果说明, 有10%的RGCs存活, 就具备使视功能恢复的能力。Chow[18]和Galambos等[19]也证明, 2%~3%的视神经纤维与外膝体存在突触联系, 就能够具有较好的视功能。Hubel和Wiesel[20]发现, 有1%的细胞存在反应, 就能够产生一定的功能恢复。本实验结果发现, OECs移植、α 晶体蛋白玻璃体腔注射, 以及两者联合组, P1振幅于视神经损伤后7 d即有明显的恢复, OECs移植组及OECs与α 晶体蛋白联合组, P1振幅恢复情况于视神经损伤后3个月仍非常显著, 但α 晶体蛋白组于视神经损伤后2个月P1振幅较损伤1周、2周及1个月下降明显, 这可能与α 晶体蛋白单次注射, 保护RGCs存活及促进视神经再生作用持续短暂有关。与OECs移植组及α 晶体蛋白组比较, 各时间点OECs与α 晶体蛋白联合组P1振幅恢复情况均最为显著, 提示, OECs与α 晶体蛋白联合能更有效地促进损伤视神经的功能修复。本实验各实验组的P1潜伏期均无明显的恢复, 提示OECs与α 晶体蛋白不能促进视神经纤维髓鞘化, 与Li等[2]的研究结果相似, 视神经横断局部移植的OECs能伴随视神经纤维生长, 但未形成髓鞘。
本实验通过大鼠视神经损伤后FVEP检测, 证明OECs移植与α 晶体蛋白均明显促进视神经损伤后视功能的恢复, 但二者联合的作用更为明显。为神经损伤和再生的基础研究提供理论依据, 为神经损伤后再生及功能修复提供新思路。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|