作者简介:杜春彦,硕士研究生,医师。
目的 探讨干扰素γ(interferon-γ,IFN-γ)预处理大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)及其抑制脂多糖(lipopolysaccharide ,LPS)诱发的小胶质细胞(microglia,MG)活化作用的影响。方法 采用全骨髓贴壁法分离培养大鼠BMMSCs,利用含100 ng/ml 的IFN-γ完全培养液对BMMSCs进行预处理;利用LPS(10μg/ml)诱导大鼠小胶质细胞活化。小胶质细胞分离纯化后,以1×105/孔种植于6孔板中,按以下分组将小胶质细胞和BMMSCs以直接接触的方式进行共培养24h:B组(单纯BMMSCs组)、L+B组(LPS+ BMMSCs组)、I+B组(IFN-γ预处理BMMSCs组)、L+I+B组(LPS+IFN-γ预处理BMMSCs组)、M组(单纯MG组)、L+M组(LPS+MG组)、B+L+M组(BMMSCs+LPS+MG组)、I+B+L+M组(IFN-γ预处理BMMSCs+LPS+MG组)。采用ELISA技术检测培养液上清TNF-α、IL-1β水平,免疫荧光法检测小胶质细胞表面标记物CD68表达。结果 L+M组小胶质细胞CD68表达增高,分泌TNF-α、IL-1β含量明显增多;B+L+M组以及I+B+L+M组的小胶质细胞CD68表达水平、TNF-α、IL-1β分泌量低于L+M组,且B+L+M组与I+B+L+M组相比有统计学差异( P<0.05)。结论 BMMSCs和IFN-γ预处理的BMMSCs均可以直接接触的方式抑制LPS诱发的小胶质细胞的活化且经IFN-γ预处理后的BMMSCs对小胶质细胞活性抑制作用更强。
Objective To explore the inhibitory effect of pre-treatment of one marrow mesenchymal stem cells (BMMSCs) with interferon-γ and IFN-γ on the activation of microglia(MG) induced by lipopolysaccharide(LPS).Methods BMMSCs were isolated and cultured using the whole bone marrow adherence method. Then, 100ng/ml IFN-γ was used to induce the activation of BMMSCs and10μg/ml lipopolysaccharide was used as the inflammatory stimulating factor to induce the activation of microglia. After isolation and purification, microglia were seeded in 6-well plates at the density of 1×105/well and BMMSCs were co-cultured with microglia with the cell contact cell method for 24 h in the following groups: B group(BMMSCs group), L+B group(LPS+BMMSCs group), I+B group(IFN-γ pretreatment BMMSCs group), L+I+B group(LPS+IFN-γ pretreatment BMMSCs group), M group(microglia group), L+M group(LPS+ microglia group), B+L+M group(BMMSCs+ LPS+ microglia group), and I+B+L+M group(BMMSCs pretreated with IFN-γ+LPS+ microglia group). 24 hours later, the expressions of TNF-α、IL-1βin cell culture supernatants were detected by ELISA kit and the expression of microglia surface marker CD68 was detected by immunofluorescence.Results In the L+M group,LPS promoted the expression of CD68 and the production of TNF-α and IL-1β in microglial cells. The expression of CD68 and the production of TNF-α and IL-1β in B+L+M group and I+B+L+M group were lower than in L+M group, and there was statistically significant difference between the B+L+M group and the I+B+L+M group(
神经病理性疼痛是由躯体感觉神经系统的损伤或疾病造成的慢性疼痛, 近年来多个研究发现间充质干细胞移植可减轻外周或中枢神经损伤造成的机械性和热性痛觉过敏[1, 2, 3]。Procko 等[4]发现, 干细胞可被移植微环境中的炎性因子激活, 通过自身的旁分泌功能抑制小胶质细胞的激活, 进而发挥减轻神经病理性疼痛的作用[5, 6]。王炜炜和李恒等[7]发现, 移植微环境中的炎性反应因子能激活BMMSCs的免疫抑制作用。但是, 目前尚无研究涉及炎性反应因子预处理干细胞能否增强其抑制小胶质细胞活化的功能, 本研究拟利用IFN-γ 对BMMSCs进行预处理, 探讨其对小胶质细胞活化作用的影响。
4~6周龄清洁级雄性SD大鼠6只, 体重60~80 g, 由解放军总医院动物研究中心提供。
1.2.1 试剂 SD大鼠小胶质细胞(北京裕恒丰科技公司)、SD大鼠基础培养液α -MEM(Corning)、胎牛血清FBS(Corning)、0.25%胰酶(GIBICO)。小鼠抗大鼠CD68抗体(BD), fluor 594标记羊抗小鼠二抗(Invitrogen), 大鼠TNF-α ELISA试剂盒(Raybio)、大鼠IL-1β ELISA试剂盒(Raybio)。
1.2.2 仪器 CO2培养箱(德国Heraeus, BB5060), 倒置显微镜(日本Olympus, IX70), 光学显微镜及照相设备(日本Nikon, BH-2), 高速离心机(美国Beckman, AllegraX-22R), 酶标仪(美国贝克曼DTX-880)
1.3.1 BMMSCs分离培养与鉴定 将SD大鼠麻醉处死, 无菌条件下取大鼠股骨、胫骨, 用α -MEM反复冲洗骨髓腔至骨发白, 收集细胞悬液, 1500 r/min离心5 min后弃上清, α -MEM培养液重悬, 吹打均匀后以2× 105/cm2浓度接种于T25培养瓶中, 置于37 ℃、体积分数为5%CO2培养箱内培养。应用差异贴壁方法分离纯化细胞, 待细胞达到80%融合时传代培养。取P3代细胞光镜下观察细胞形态, 流式细胞仪检测BMMSCs表面标志物CD29、CD90及造血干细胞表面标志物CD34、CD45。
1.3.2 IFN-γ 预处理 BMMSCs取生长状态良好的P3代BMMSCs以2× 105的密度种植于培养皿中, 加入含100 ng/ml IFN-γ 培养液后继续培养24 h, 使用0.25%的胰酶消化3 min, 收集细胞以备与小胶质细胞共培养使用。
1.3.3 BMMSCs与大鼠小胶质细胞共培养 将大鼠小胶质细胞复苏后以5× 104个/孔种植于6孔板中, 待细胞贴壁后使用无血清培养液进行饥饿处理12 h, 后按以下分组将其与BMMSCs以直接接触的方式、按BMMSCs(1× 105个/孔):小胶质细胞(5×
104个/孔)的比例进行共培养:B组(单纯BMMSCs组)、L+B组(LPS+ BMMSCs组)、I+B组(IFN-γ 预处理BMMSCs组)、L+I+B组(LPS+IFN-γ 预处理BMMSCs组)、M组(单纯MG组)、L+M组(LPS+MG组)、B+L+M组(BMMSCs+LPS+MG组)、I+B+L+M组(IFN-γ 预处理BMMSCs+LPS+MG组)。其中LPS的浓度为10 μ g/ml。共培养24 h后, 收集培养液上清检测TNF-α 、IL-1β 水平, 并用免疫荧光法检测小胶质细胞的活化情况。
1.3.4 ELISA法测定 TNF-α 、IL-1β 的含量按照ELISA试剂盒的说明步骤操作, 检测各组细胞培养上清液中TNF-α 、IL-1β 的水平
1.3.5 免疫荧光技术检测各组小胶质细胞活化情况 留取M组(单纯MG组)、L+M组(LPS+MG组)、B+L+M组(BMMSCs+LPS+MG组)、I+B+L+M组(IFN-γ 预处理BMMSCs+LPS+MG组)进行CD68的免疫荧光染色。细胞爬片, 用PBS 漂洗5 min, 3 次; 加入 0.3%过氧化氢溶液封闭内源性过氧化物酶30 min; PBS 漂洗5 min, 3 次; 封闭液封闭1h, PBS 漂洗5 min, 3 次; 加一抗小鼠抗大鼠CD68(1∶ 250), 4 ℃孵育过夜; PBS 漂洗5 min, 3 次; 加二抗fluor594标记羊抗小鼠荧光二抗(1∶ 200), 室温避光孵育1 h; PBS 漂洗5 min, 3 次; 使用抗荧光衰减封片剂封片。荧光显微镜下观察拍片, 每片各随机选取7个视野观察并计算CD68阳性的小胶质细胞的百分比。
采用SPSS19.0软件对所有数据进行统计分析, 计量数据以
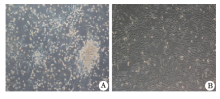
原代培养细胞接种2 d后, 细胞呈悬浮样生长, 细胞形态以圆形为主, 镜下可见细胞呈梭形或多角形态, 随着换液和继续培养, 培养瓶中贴壁细胞数量逐渐增多, 悬浮细胞数量减少。原代培养的细胞在接种1周后细胞集落达到80%融合。传代后的BMMSCs分裂、增殖速度明显变慢, 大部分贴壁细胞保持长梭形, 培养2周后, 杂质细胞明显减少, 细胞呈放射状排列, 融合片状生长, 形成典型漩涡状形态, 细胞纯度较高(图1)。
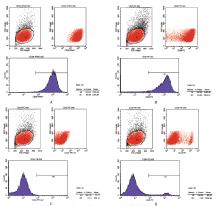
经鉴定, 细胞表面抗原CD29表达率99.59%, CD90表达率83.95%,
呈阳性; CD34表达率0.1%, CD45表达率7%, 呈阴性(图2)。结果表明分离培养的细胞符合BMMSCs的生物学特性且纯度较高, 适合实验需要。
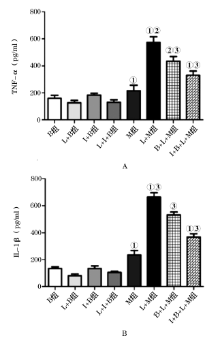
小胶质细胞被LPS激活后TNF-α 和IL-1β 含量均明显上升, 与M组相比有统计学差异(TNF-α :P=0.000; IL-1β :P=0.000)。与L+M组相比, B+L+M组以及I+B+L+M组的TNF-α 和IL-1β 表达水平下降(图3), 且后2组之间相比有明显统计学差异(TNF-α :P=0.026; IL-1β :P=0.001)。B组、I+B组、M组、L+B组, L+I+B组TNF-α 、IL-1β 的水平均较低, 且各组间差异无统计学意义。
M组小胶质细胞大部分呈梭形, 细胞表面有许多棘突(图4)。L+M组小胶质细胞胞体明显增大, 细胞突起回缩变粗呈 “ 阿米巴样” 。 单纯给予BMMSCs处理后, 小胶质细胞形态无明显变化; 予IFN-γ 干预后的BMMSCs处理小胶质细胞后, 小胶质细胞形态改善, 再次呈现分支样形态。M组小胶质细胞表面抗体CD68的阳性率为24.7%, L+M组CD68的表达率为55.2%, 两组相比有统计学差异(P=0.001); B+ L+M组CD68表达率为35.2%, 低于L+M组( P=0.005); I+B+L+M组CD68为13.9%, 低于L+M组(P=0.000); I+ B+ L+M组与B+L+M组相比差异有统计学意义(P=0.003)。
干细胞预处理的应用源于不良移植微环境对干细胞存活和功能发挥的影响, 最早被用于心肌梗死的治疗研究。多种预处理方法可激活干细胞在不同疾病环境中的细胞保护通路。如缺氧、炎性反应因子、基因修饰和药物预处理均可提高干细胞在心肌梗死、原发性肺纤维化、脊髓缺血再灌注损伤模型中的生存和增殖, 并产生梗死面积缩小、左心室射血分数升高、心功能显著改善、肺修复能力增强和神经功能评分提高等宏观保护作用[8, 9, 10, 11]。但是, 目前尚无关于预处理干细胞抑制小胶质细胞活化作用的影响的研究报道。众所周知, 小胶质细胞的活化在外周及中枢神经病理性疼痛的产生和维持中发挥着非常重要作用, 而干细胞则可能通过促使小胶质细胞进入休眠状态、降低其对促炎因子的反应[12, 13]等机制抑制小胶质细胞的活化, 因此, 如何增强干细胞对小胶质细胞活化的抑制作用有重要意义。
炎性反应因子与干细胞的微妙关系使其成为预处理的有力候选者。大量研究发现, 干细胞只有在足量促炎细胞因子的刺激下才能发挥其免疫抑制作用[14, 15, 16]。干细胞产生多种抑制性因子的能力与促炎因子TNF-α 、IFN-γ 或Toll样受体配体的水平息息相关[17]。 IFN-γ 是炎性因子中重要的一员, 具有广泛生物学活性, 作为治疗药物被用于抗病毒、抗肿瘤和调节免疫反应。微量IFN-γ 即可激活间充质干细胞的免疫调节活性, 因此本研究采用IFN-γ 对干细胞进行预处理。本研究结果提示, 100 ng/ml的IFN-γ 预处理可增强BMMSCs抑制LPS诱发的小胶质细胞的活化。其机制可能为IFN-γ 可与干细胞表面的模式识别受体(pattern recognition receptor, PRR)结合, 通过JAK/STAT信号转导途径促进干细胞活化, 活化后的干细胞通过旁分泌机制诱导小胶质细胞向M2型活化, 抑制炎性反应因子的释放, 进而对神经病理性疼痛的治疗发挥作用[18, 19]。Mohammadpour等[6]发现, TNF-α 与IFN-γ 联合刺激小鼠脂肪间充质干细胞可促进脂肪间充质干细胞增殖、激活干扰素应答基因的转录, 从而促进小胶质细胞凋亡、减弱小胶质细胞过度激活对组织所致的损伤, 进而发挥对内部损伤组织的保护作用。但该作用是否有剂量依赖性及其潜在作用机制有待进一步探讨。同时, 他还发现BMMSCs可抑制LPS诱发的小胶质细胞的活化, 抑制小胶质细胞表面标记物CD68的表达, 减少其促炎因子TNF-α 、IL-1β 的分泌水平, 这与周小琳等[20]研究结果一致。本研究不足之处:只选用一种细胞因子IFN-γ 对BMMSCs进行预处理, 可能存在预处理细胞因子过于单一的问题, 但研究结果提示IFN-γ 预处理BMMSCs后其仍具有抑制小胶质细胞活化的功能。因此, 下一步研究中, 拟采用多种细胞因子联合预处理并对给予的细胞因子浓度进行验证, 以期找到预处理更合适的炎性反应因子和浓度。
综上所述, 采用IFN-γ 对BMMSCs进行预处理, 以直接接触模式将其与LPS活化的小胶质细胞进行共培养, 发现IFN-γ 预处理的BMMSCs可更显著抑制LPS诱发的小胶质细胞的活化, 这为干细胞更有效的临床应用提供了理论基础, 但多种炎性反应因子联合预处理能否进一步增强干细胞抑制小胶质细胞活化的作用尚需进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|