目的 观察用骨硬化蛋白抗体拮抗肿瘤细胞骨硬化蛋白(sclerostin)功能对乳腺癌MDA-MB-231 细胞骨转移能力的影响。方法 骨硬化蛋白单链抗体(Sci-Ab)和MDA-MB-231细胞共培养,观察细胞侵袭和迁移能力的改变。24只6~8周龄雌性裸鼠被随机分为两组, 每组12只,每只裸鼠分别以5×106个MDA-MB-231 细胞注射入左侧股骨骨髓腔。对照组注射生理盐水治疗,实验组给予骨硬化蛋白抗体(Sci-Ab)治疗,35 d后行病理检查, 比较两组骨转移发生率和骨肿瘤体积大小。取小鼠股骨,经micro-CT扫描并三维重构,观察各组小鼠骨破坏情况。定量资料的比较采用 t检验, 定性资料比较采用Fisher 确切概率检验。结果 MTT实验和划痕实验表明,高浓度的Sci-Ab促进 MDA-MB-231增值和侵袭( P<0.05)。对照组有6 只发生骨转移, 治疗组有9只发生骨转移。治疗组的骨转移发生率虽高于对照组, 但两者差异无统计学意义( P=0.30)。对照组肿瘤平均体积为(0.87±0.244) cm3,治疗组肿瘤平均体积为(0.73±0.118) cm3, 两组间差异无统计学意义( P=0.35)。治疗组的生存率高于对照组,有统计学差异( P<0.05)。Micro-CT分析表明,骨硬化蛋白抗体治疗能够阻止乳腺癌导致的骨损伤并且骨密度高于对照组,两组间差异有统计学意义( P<0.05)。结论 乳腺癌细胞致骨转移能力与骨硬化蛋白表达水平密切相关, 抑制骨硬化蛋白表达可以提高乳腺癌细胞致骨转移的能力,但是能够提高乳腺癌骨转移模型小鼠的生存率,生存率的提高可能与阻止乳腺癌骨转移所介导的骨破坏相关。
Objective To investigate the impact of inhibiting the function of sclerostin by antibodies in tumor cells on MDA-MB-231 induced bone metastasis.Methods MDA-MB-231 cells were co-cultured with sclerostin antibody(Sci-Ab). Twenty-four female nude mice aged 6 -8 weeks were divided randomly into two groups (
乳腺癌是女性最常见的恶性肿瘤, 且70%~80%可发生骨转移[1, 2, 3]。一旦发生骨转移, 常常会引发一系列骨髓系统相关疾病, 从而严重影响生活质量, 降低生存时间[3, 4, 5, 6, 7]。乳腺癌骨转移治疗效果差, 寻求新的治疗靶点是治疗该病的一个重大课题。
骨硬化蛋白是由骨细胞分泌通过阻断WNT信号通路对成骨有抑制作用的蛋白, 对维持骨稳定起关键作用[8, 9]。Wnt/β -catenin信号通路的过度激活和癌症的发生发展有重要关系[10, 11, 12]。研究发现, 在骨髓瘤患者中骨硬化蛋白水平增高并且升高的骨硬化蛋白通过抑制成骨过程, 破坏了骨吸收与合成平衡[13, 14]。在乳腺癌各期, 发生骨转移过程中, 血清中骨硬化蛋白表达水平的升高和溶骨性骨破坏有密切关系。部分乳腺癌细胞株表达骨硬化蛋白已被证实, 但肿瘤细胞骨硬化蛋白的表达在骨转移过程中的作用目前还不清楚。本研究利用骨硬化蛋白抗体[15](Sci-Ab)抑制乳腺癌MDA-MB-231 细胞株骨硬化蛋白的功能, 研究对照组和治疗组细胞的增殖、迁移和侵袭能力, 以及通过构建乳腺癌骨转移模型研究肿瘤细胞自身分泌的骨硬化蛋白在乳腺癌骨转移过程中的作用。
人乳腺癌MDA-MB-231 细胞株购自北京协和医院细胞库。骨硬化蛋白抗体[16, 17](液体), 由中国科学院微生物研究所提供。H-DMEM高糖培养液、0.25%胰蛋白酶和胎牛血清购自Hyclone公司, 青霉素、链霉素由Sigma公司购买, 1× PBS缓冲液和75%乙醇溶液, 0.4%台盼蓝溶液。
BALB/C-nu/nu雌性裸鼠24只, 6~8周龄, 体质量20~30 g, 购自北京维通利华生物科技有限公司, 动物于首都医科大学附属北京世纪坛医院动物实验中心SPF条件下饲养, 保持恒温(25~27 ℃)、恒湿(40%~50%), 每日以小鼠专用饲料饲养。将实验裸鼠随机分为两组, 每组12只, 每只注射MDA-MB-231 细胞5× 106至股骨骨髓腔内, 1周后对照组给予生理盐水治疗, 治疗组给予骨硬化蛋白抗体(Sci-Ab)治疗。
H-DMEM培养液(含10%胎牛血清)在37 ℃、5%CO2条件下培养MDA-MB-231细胞株, 每2 d或3 d更换培1次养液。待培养皿中细胞达80%左右时传代。以0.25%胰蛋白酶消化对数生长期的MDA-MB-231细胞, 室温下以1000 r/min, 离心5 min, 用1× PBS液漂洗、反复吹打重悬MDA-MB-231。用0.4%台盼蓝溶液染色, 镜下观察, 细胞计数。
将处于对数生长期的MDA-MB-231细胞分成二组Sci-Ab(对照组加PBS溶液, 实验组加入等量PBS溶解的Sci-Ab 2 μ g/ml)预治疗24 h后经胰酶消化接种于96孔细胞板中, 每孔接种200 μ l, 细胞浓度为5000/ml。然后放入CO2培养箱静置培养。每孔对应加入Sci-Ab(照组加PBS溶液, 实验组加入等量PBS溶解的Sci-Ab 2 μ g/ml)继续孵育分别至1, 2, 3, 4 d。细胞每24 h更换相同药物浓度培养液。分别培养1, 2, 3, 4 d后弃培养液, 换成无血清的H-DMEM培养液, 然后加入噻唑蓝MTT 20 μ l继续37 ℃培养4 h, 弃上清每孔加入DMSO 150 ml, 室温下振荡15 min。酶标仪490 nm波长, 在酶联免疫监测仪上测定各孔光吸收值, 记录实验结果。
6孔板每孔接种不同浓度Sci-Ab(0、1、4 μ g/ml)预治疗24 h的50 000个细胞, 待细胞汇合达到80%~90%时, 用10 μ l的枪头划痕, PBS洗3次, 加入含10%胎牛血清的高糖DMEM培养基继续培养, 于0、24、48 h取出孔板, 在同一观察点处照相观察划痕愈合情况。比较各组细胞划痕的愈合情况。
以0.3 ml/mg的10%的水合氯醛腹腔注射麻醉裸鼠, 75%乙醇消毒皮肤, 裸鼠仰卧位, 在膝盖, 髌韧带和肌肉处做一切口纵向分裂暴露股骨远端, 多次反复吹打细胞悬液, 以100 μ l的微量注射器吸取20 μ l细胞悬液(细胞数为5× 106/ml), 于裸鼠股骨远端进针, 缓慢且均匀地向骨髓腔注射细胞悬液, 骨蜡封闭针孔, 缝合肌腱、韧带、伤口等。1周后对照组给予0.9%的生理盐水治疗, 治疗组给予骨硬化蛋白抗体(Sci-Ab)治疗。
于肿瘤细胞注射后60 d处死裸鼠, 肉眼观察骨转移肿瘤形成情况, 如发生骨转移, 则以10%多聚甲醛固定3 d后, 用10 %盐酸脱钙, 然后乙醇脱水, 常规石蜡包埋, 制作切片, 行苏木精-伊红染色, 在显微镜下观察切片并判断是否为骨转移。对裸鼠股骨进行解剖, 测量骨肿瘤最长径(a)和最短径(b), 根据公式计算肿瘤体积:体积=a× b2/2。
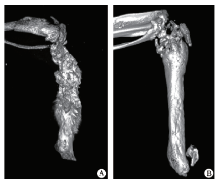
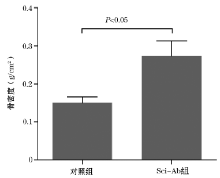
BALB/c磁性小鼠各12只, 麻醉处死后切取股骨固定于无水乙醇中。采用小动物micro-CT(Inveon MM CT, SIEMENS, 德国)进行扫描, 扫描条件为:电压60 kV, 电流220 mA, 滤片0.5, 深度16 bit, 曝光时间1500 ms, 分辨率为8.99 μ m, 对同一标本获得500张不同横截面2048× 3072像素的图片。应用COBRA_Exxin三维重建处理软件和Inveon Research Workplace分析软件, 小鼠的股骨扫描图片进行三维图像重建, 选取2组小鼠重组图像相同位置的股骨上端感兴趣区域(region of interest, ROI)进行定量分析, 组织骨密度(bone mineral density , BMD)以g/cm2表示。
应用SPSS 20.0软件进行统计分析。计量资料的比较采用t检验或秩和检验, 计数资料比较采用Fisher 精确概率检验, 以P< 0.05为差异有统计学意义。
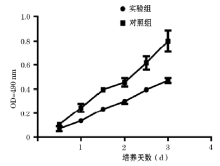
MTT法绘制细胞生长曲线, 将实验分为对照组和实验组(对照组加PBS, 实验组加入等量PBS溶解的Sci-Ab 2 μ g/ml)分别孵育1, 2, 3, 4 d。根据生长曲线, 高浓度的Sci-Ab促进 MDA-MB-231增值并且Sci-Ab作用不同组之间生长曲线有显著性差异(P< 0.05, 图1)。
划痕试验分析显示, 铺种完细胞后1 d, 当细胞汇合度达到80%~90%时, 在3组细胞的板孔中间用10 μ l枪头划一道适当宽度的伤痕, 用PBS轻轻冲洗培养板后换用无血清培养基继续培养。24 h、48 h后, 高浓度的Sci-Ab可促使划痕面积减少, 愈合率高于未治疗组(图2)。Sci-Ab可以诱导MDA-MB-231细胞迁移。
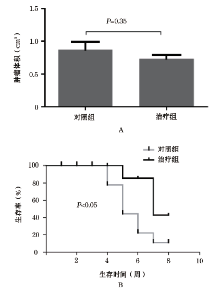
对照组共有6只裸鼠出现骨转移, 平均体积为(0.87± 0.244) cm3; 治疗组共有9只裸鼠出现骨转移, 平均体积为(0.73± 0.118) cm3。治疗组骨转移发生率高于对照组而肿瘤体积低于对照组, 但两者差异并无统计学意义(P=0.30, P=0.35, 图3A)。
根据两组小鼠的生存曲线, 治疗组的生存率高于对照组, 差异有统计学意义(P< 0.05, 图3B)。
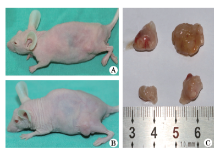
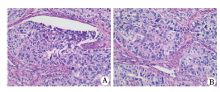
大体解剖肉眼观察骨转移肿瘤呈团块状突出骨质表面, 颜色呈灰白色(图4A, B, C)。显微镜下观察可见肿瘤细胞排列紊乱, 形态不规则, 细胞分化差, 细胞核大, 形态不一、染色较深, 肿瘤细胞有侵润周围组织表现(图5)。
乳腺癌患者一旦发生骨转移, 常常引发一系列骨髓相关疾病, 导致患者生存率明显降低[18]。但迄今为止乳腺癌骨转移机制仍未完全阐明, 严重影响对乳腺癌骨转移预防和治疗。本研究表明抑制骨硬化蛋白可以促进MDA-MB-231增值和侵袭, 并且小鼠模型实验提示, 抑制骨硬化蛋白可以诱导骨转移发生, 但是一定程度上抑制了乳腺癌所介导的骨破坏, 从而提高小鼠的生存率。
Colucci等[14]发现, 骨髓瘤患者中骨硬化蛋白的水平升高, 骨硬化蛋白可以通过抑制成骨介导骨破坏, 并且进一步证明了, 骨保护素的下调和NF-kB受体活化因子(receptor activator of NF-kappa B, RANK)的上调相关。最近对大量患者研究发现, 多发性骨髓瘤患者中较高水平的骨硬化蛋白组的生存率明显低于较低组[13]; 在非小细胞肺癌患者中SOSTDC1明显降低[19], 且SOSTDC1较高的患者有较好的临床愈后。但是, 对于骨硬化蛋白与乳腺癌骨转移的关系未做深入研究。本研究通过MDA-MB-231细胞与骨硬化蛋白单克隆抗体共同培养, 抑制细胞内骨硬化蛋白的功能, 发现骨硬化蛋白降低后, 乳腺癌细胞的增值和侵袭能力明显增强。Khramtsov等[11]发现Wnt/β -catenin信号通路过度激活的乳腺癌患者愈后差。本研究发现, Sci-Ab使MDA-MB-231细胞增值和侵袭能力增强有可能与Sci-Ab激活Wnt/β -catenin信号通路有关。Wnt/β -catenin信号通路的异常激活在肿瘤的形成、发展中发挥重要作用[20, 21]。小鼠的体内实验表明, 经过骨硬化蛋白抗体治疗组小鼠生存率明显提高, 也许和抗体拮抗骨硬化蛋白对骨的破坏相关。
Micro-CT通过X线扫描和三维重建技术, 一次扫描同时测量骨微结构与骨密度等的多项参数[22, 23, 24], 在三维重建模型上得到更精确骨结构的数据, 能够更准确的对骨的质量作出评价。本研究发现, 骨硬化蛋白抗体治疗能够阻止乳腺癌导致的骨损伤, 提高骨密度。Eda等[24]发现, 多发性骨髓瘤细胞分泌骨硬化蛋白, 抑制成骨细胞的分化, Sci-Ab可以逆转骨髓瘤导致的骨破坏。
总之, 本研究表明, 骨硬化蛋白抗体能够拮抗乳腺癌细胞分泌骨硬化蛋白所致的骨代谢失衡, 进而保护骨, 降低小鼠的病死率, 但是促进了MDA-MB-231细胞的增殖和侵袭, 并且诱使小鼠发生骨转移。骨硬化蛋白与乳腺癌骨转移的作用机制有待进一步研究。骨硬化蛋白与Wnt/β -catenin信号通路在肿瘤细胞的增值和迁移及骨的重塑过程中发挥的作用, 有可能是一种新的治疗乳腺癌骨转移所致的骨疾病的方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [22] |
|
| [24] |
|