作者简介:沈学成,博士,主治医师。
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是胃肠道间叶源性肿瘤的最常见类型, 多发于胃和小肠部位。GIST起源于Cajal间质细胞(interstiotial cells of cajal, ICC), 其特征是具有酪氨酸激酶受体和骨髓干细胞抗原表达阳性。因此, 免疫组化染色CD117和CD34的阳性是诊断GIST的重要病理学依据。GIST大多数发生在消化道, 较少被发现在胃肠道外组织, 被称为胃肠道外间质瘤(extra-gastrointestinal stromal tumor, EGIST), 多发于肠系膜、网膜等部位, 腹膜后间质瘤十分少见。我院于2016-02-01收治1例, 现结合文献报告如下。
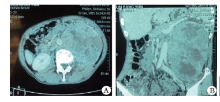
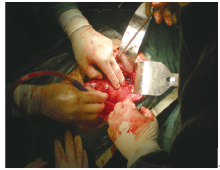
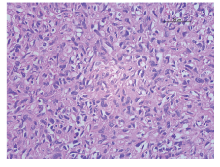
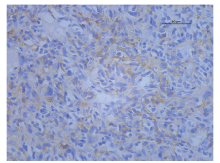
患者, 男性, 67岁, 发现左侧腰部包块两年余入院。查体:左腰部可触及一包块, 大小20 cm× 13 cm。腹部B超示:左侧肾区占位性病变, 左肾区可探及1个外形不规则中等回声包块, 大小192 mm× 130 mm× 115 mm。双肾+输尿管+膀胱CT平扫+增强示:左肾占位, 考虑肾癌伴囊变出血及左肾积水(图1)。胸部CT平扫提示:两肺多发占位, 转移不能除外。ECT提示:左肾大小、形态尚正常, 血流灌注尚可, 滤过功能中度受损, 左侧上尿路引流不畅, 右肾体积增大, 血流灌注正常, 滤过及排泄功能正常; 肾小球滤过率(ml/min):左=20.6, 右=50.3。完善相关检查排除手术禁忌, 在全身麻醉下行“ 左侧腹膜后肿瘤加左肾切除术” , 术中见左侧腹膜后巨大肿瘤, 自腹膜后向腹腔内突出, 降结肠及肠系膜与肿瘤粘连严重, 向上下扩展后腹膜切口, 显露肿瘤。瘤体巨大, 20 cm× 18 cm× 18 cm, 质地硬且固定, 肿瘤内侧与腹主动脉粘连, 上方浸润左肾(图2)。腹膜后间隙均为肿瘤占据, 无手术空间, 自外侧钝性剥开肿瘤包膜, 将肿瘤瘤体及包膜分次剜除取出, 肿瘤上方游离出左肾蒂, 结扎肾动脉和肾静脉, 于远端离断输尿管并结扎, 完全切除肿瘤及左肾。术后病理示:肿瘤组织为梭形细胞恶性肿瘤, 免疫组化提示:CD34(+)、CD117(+)、SMA(+)、Ki67阳性细胞50%, 病理诊断为腹膜后间质瘤(图3、4); 患者术后2周出院, 因经济原因拒绝伊马替尼治疗, 随访6个月后死于多脏器转移。
EGIST与GIST有着相似的组织学形态及肿瘤细胞表达, 均来源于消化道的Cajal细胞, KIT或PDGFRA基因获得性突变被认为是其发病机制的核心。组织学类型主要是梭形细胞肿瘤[1]。此外, 包括其他组织学类型, 如上皮样和黏液样细胞肿瘤[2]。组织病理学是诊断的金标准, 免疫组化染色CD117阳性是诊断GIST的主要病理学依据, 其他阳性抗原还包括CD34(70%)[3], MSA(50%), SMA(35%~40%)[4], S-100 (10%)和DES(5%)[5]。
腹膜后间质瘤作为EGIST的一种类型, 具有自身的临床病理特点:(1)多为单发肿块; (2)多为恶性; (3)肿瘤体积较大; (4)血供较丰富, 坏死囊变较常见; (5)可转移肝、肺等部位, 一般不伴腹腔及腹膜后淋巴结转移。GIST 预后的主要影响因素包括肿瘤大小、核分裂相以及肿瘤位置[6], 其他的还包括黏膜侵袭、细胞构成、突变点、性别及伴随症状[7]。EGIST良恶性的诊断标准为[8]:良性, 肿瘤直径< 5 cm, 肿瘤细胞病理核分裂象< 5个/50 HPF; 低度恶性潜能, 肿瘤直径> 5 cm, 肿瘤细胞病理核分裂象< 5个/50 HPF、有或无坏死、细胞密度减低; 恶性, 肿瘤直径> 5 cm, 肿瘤细胞病理核分裂象≥ 5个/50 HPF, 有坏死和(或)细胞密度增高。本文报道病例为单发肿瘤, 瘤体巨大, 直径20 cm, 血供丰富, 瘤体内可见坏死囊变, 且伴有双肺转移, 符合腹膜后间质瘤的临床特点, 恶性程度高, 预后不良。
腹膜后间质瘤与其他肿瘤的鉴别诊断[9]:(1)脂肪肉瘤:不均质肿块, 包膜不完整, 常沿肾周间隙浸润性生长, 并常见坏死、囊变、出血, 有脂肪密度混杂的不均质实性密度是其特征性表现; (2)平滑肌肉瘤:肿块巨大, 中央常伴不规则坏死, 出血及钙化少见, 增强扫描呈明显环状强化, 有浸润血管倾向, 绝大多数不表达CD117和CD34; (3)恶性纤维组织细胞瘤:肿瘤较大并向周围浸润生长, 血供丰富, 肿瘤内坏死显著, 出血常见, 团块状或环状钙化是其特征性表现; (4)血管外皮细胞瘤:为富血供肿瘤, 内含斑点状钙化, 强化明显且持续时间长是其特点; (5)神经鞘瘤:肿块边缘清楚, 常位于脊柱两侧, 可见对应的椎间孔扩大, 易囊变, 增强扫描呈实性部分明显强化, 恶性者表达S-100蛋白。本例患者术前拟诊断为肾癌, 术中发现肿瘤侵及左肾, 与左肾界限不清, 瘤体内有出血及坏死囊变。故腹膜后间质瘤的鉴别诊断难度较大, 除影像学检查作为诊断参考外, 病理提示梭形细胞恶性肿瘤, 免疫组化:CD34(+)、CD117(+), 为腹膜后间质瘤诊断的金标准。
外科手术、化疗、放疗是目前治疗EGIST的主要方法, 但疗效并不令人满意[10]。目前治疗观念已经转变, 酪氨酸激酶抑制药伊马替尼和索马替尼已被成功地应用于预防和治疗GIST的复发转移[11], 对不能切除的、转移的或复发的EGIST有很好的疗效。酪氨酸激酶蛋白的突变仍然是胃肠道间质瘤的重要的发病机制[12]。GIST细胞依赖一条对它们的增殖激活的生长途径, 如果撤除这条途径将导致其死亡, 该机制称为细胞凋亡[13]。伊马替尼治疗GIST, 可以有效地撤除该生长途径, 导致细胞凋亡。伊马替尼可以有效杀死转移到身体其他部位、已不能行手术切除的GIST细胞。作为常规一线药物的伊马替尼若剂量不能耐受, 则可用二线药物索马替尼, 但对于大多数肿瘤, 手术切除仍是主要办法, 切除后辅以靶向治疗 。本例患者术后2周出院, 因经济原因拒绝伊马替尼治疗, 随访6个月后患者死于多脏器转移。
总之, EGIST 作为一种胃肠道外的GIST, 在临床表现方面很难与一般的肿瘤相鉴别, 仅通过临床表现和影像学很难确诊。临床医师需要根据组织免疫组化染色呈现特殊的标志确诊, 进而可根据病理诊断结果确定治疗方案, 防止误诊。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|