糖尿病是心血管疾病最常见的易患因素之一, 同时也是心肌梗死的独立高危因素[1], 对心血管疾病的治疗及预后产生重要的影响。高糖和缺氧也是临床常见的心肌损伤因素, 高糖导致心肌细胞凋亡和心肌纤维化[2], 缺氧导致心肌细胞坏死[3], 最终都造成心肌细胞数量减少, 心肌收缩力减弱, 对心脏功能造成不可逆损伤。已有证据表明, 心血管并发症在糖尿病人群的致死率是非糖尿病人群的3~5倍[4], 缺血性心脏病在糖尿病人群的发病率是非糖尿病人群的2倍[5]。利拉鲁肽是胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)的类似物, 目前主要应用于2型糖尿病的治疗。最新的研究发现, 利拉鲁肽在发挥降糖作用的同时还具有一定的心肌保护作用[6], 但对其药理作用机制的研究尚不完善。本研究采用体外培养高糖孵育的乳鼠心肌细胞经缺氧处理, 模拟糖尿病心肌细胞缺血损伤病理过程, 从抑制钙超载和心肌细胞凋亡的角度, 探讨利拉鲁肽对缺氧和高糖诱导的心肌细胞损伤的保护作用及可能机制。
利拉鲁肽注射液(Novo Nordisk公司, 丹麦), 二甲基亚砜( DMSO)(Amresco 公司, 美国), DMEM/F-12培养液、胎牛血清(Gibco公司, 美国), 5-溴-2-脱氧尿嘧啶(Brdu)、TritonX-100、胰蛋白酶、exendin-4(9-39)(Sigma公司, 美国), Fura-2/AM(Biotium公司, 美国), D-葡萄糖(天津市福晨化学试剂厂), ROS检测试剂盒、Ca2+-ATP 酶、Na+-K+-ATP酶测定试剂盒、考马斯亮蓝蛋白定量试剂盒(南京建成生物工程研究所), Annexin-V-FLUOS Staining KIT(BD公司, 美国), caspase-3 ELISA检测试剂盒(R& D公司, 美国), μ -calpain引物(Takara公司)二氧化碳培养箱(Thermo Fisher Scientific公司, 美国), 医用型超净工作台(SW-CJ-1F, 苏州), 倒置相差显微镜(CK-40, 日本Olympus), 数字式测氧仪(CYS-1型, 北京), 酶标仪(BIO-RAD, 美国), 荧光分光光度计(RF-5301PC, 日本岛津)。
新生1~3 d的SD乳鼠, 雌雄不限, 由军事医学科学院动物实验中心提供, 许可证号:SCXK-(军)2012-004。
1.3.1 乳鼠心肌细胞原代培养 新生l~3 d的SD乳鼠用75%乙醇消毒后, 取出心脏置于预冷的D-Hanks液中, 将心室肌剪成约1 mm3大小组织块, 加入0.25%胰蛋白酶(含0.02%EDTA), 于37 ℃消化并离心收集心肌细胞, 加入含10%胎牛血清的DMEM/F-12培养液和Brdu(终浓度0.1 mmol/L)接种于25 ml培养瓶中, 培养4 d后采用台盼蓝染色法检测细胞存活率[7]。
1.3.2 心肌细胞缺氧高糖模型的建立 取培养4 d的心肌细胞, 换用无血清培养液培养12 h后, 换用含30 mmol/L葡萄糖的DMEM/F-12培养液(预先充入95%N2+5%CO2混合气饱和30 min), 替代正常培养液, 而后迅速将培养板移入通有95%N2+5%CO2混合气的缺氧装置中, 维持氧浓度< 1%, 37 ℃缺氧培养3 h后进行各项指标的检测[8]。
1.3.3 实验分组 实验分为6组:(1)正常对照组:不加任何干预; (2)利拉鲁肽对照组:正常细胞培养液中加入利拉鲁肽25 nmol/L; (3)缺氧高糖模型组:细胞按“ 1.3.2” 项下方法建立缺氧和高糖模型; (4)利拉鲁肽处理组:高糖培养液中加入25 nmol/L的利拉鲁肽, 再行缺氧过程; (5)GLP-1R抑制剂组:高糖培养液中加入利拉鲁肽和exendin (9-39), 浓度均为25 nmol/L, 再行缺氧过程; (6)高渗对照组:正常细胞培养液中加入浓度为24.5 mmol/L的甘露醇。
1.3.4 细胞内ROS水平测定 心肌细胞按“ 1.3.3” 项下分组处理3 h后, 各组加入适量DCFH-DA(10 μ mol/L), 37 ℃避光孵育30 min。收集细胞, 于荧光分光光度计(激发波长480 nm、发射波长525 nm)下检测各组荧光强度。
1.3.5 心肌细胞内[Ca2+]i的测定 按Fura-2/AM 说明书, 将各组细胞经胰酶消化后收集细胞, 制备细胞悬液, 加入溶于DMSO的Fura-2/AM(终浓度为1 μ mol/L)。37 ℃恒温振荡30 min, 负载后的细胞用Hanks液离心洗涤后, 采用荧光分光光度计测定心肌细胞胞浆[Ca2+]i。
1.3.6 心肌细胞内Ca2+-ATP 酶、Na+-K+-ATP酶活性测定 接种于24孔板的心肌细胞, 按照“ 1.3.3” 项下分组进行处理3 h后, 收集各组细胞, 试剂盒测定心肌细胞内Ca2+-ATP 酶、Na+-K+-ATP酶活性, 实验操作按试剂盒说明书进行。
1.3.7 RT-PCR技术检测钙敏感的钙蛋白酶(μ -calpain)基因表达 参照Trizol试剂盒的方法提取细胞总RNA。采用反转录酶和Oligo dT引物将总RNA反转录为cDNA, 进行PCR反应。μ -calpain引物:上游:5'-GATGGAAAGCTGGTGTTCGT-3', 下游:5'-AGCTGCTCACGTTCATAGGG-3', 扩增产物长度为491 bp。β -actin引物上游:上游:5'-AAAGACCTCTATGCCAAC A-3', 下游:5'-TTGTCA AAGAAAGGGTGTAA-3', 扩增产物长度为301 bp。反应条件:94 ℃, 5 min; 94 ℃, 30 s; 59 ℃, 45 s; 72 ℃, 50 s; 72 ℃, 6 min; 35个循环后转为4 ℃保存。用凝胶成像分析系统测出各扩增条带的光密度值, 以同一样品目的基因扩增带的光密度与β -actin 扩增带的光密度比值计算出RT-PCR产物的相对含量。
1.3.8 细胞凋亡指数的测定 按照Annexin-V-FLUOS Staining KIT使用说明进行操作, 用流式细胞仪测定各组细胞凋亡率。
1.3.9 ELISA 法测定细胞培养上清中caspase-3活性 细胞按照“ 1.3.3” 项下分组进行处理3 h后, 试剂盒测定心肌细胞培养上清中caspase-3活性, 实验操作按试剂盒说明书进行。在酶标仪450 nm处测定OD值, 依据标准方程计算各样品的caspase-3水平。
数据用SPSS15.0统计软件处理, 实验结果用
心肌细胞贴壁3~4 h后, 细胞由圆形变为不规则状, 约24 h可见心肌细胞自律搏动, 48 h细胞呈现为多角形或梭形, 3 d后大部分细胞相互连接, 聚集成簇。台盼蓝染色结果显示, 细胞成活率为(95± 1.02)%, 能够满足下一步实验要求。
2.2.1 对心肌细胞内活性氧族(ROS)和游离钙离子浓度([Ca2+]i)的影响 与正常对照组相比, 缺氧高糖模型组细胞内ROS水平和[Ca2+]i显著升高(P< 0.01), 利拉鲁肽对照组和高渗对照组无显著变化(P> 0.05), 提示缺氧和高糖状态导致心肌细胞内钙超载; 与缺氧高糖模型组相比, 利拉鲁肽处理组细胞内ROS水平和[Ca2+]i显著降低(P< 0.01); 与利拉鲁肽处理组相比, GLP-1R抑制剂组细胞内ROS水平和[Ca2+]i升高 (P< 0.01)。见表1。
| 表1 利拉鲁肽对缺氧高糖状态下心肌细胞ROS和[Ca2+]i的影响(n=6; |
2.2.2 对心肌细胞Ca2+-ATP、Na+-K+-ATP酶活性的影响 与正常对照组相比, 缺氧高糖模型组细胞内Ca2+-ATP酶、Na+-K+-ATP酶活性显著降低(P< 0.01), 利拉鲁肽对照组和高渗对照组细胞无明显变化(P> 0.05); 与缺氧高糖模型组相比, 利拉鲁肽处理组细胞内Ca2+-ATP酶、Na+-K+-ATP酶活性显著增加(P< 0.01); 与利拉鲁肽处理组相比, GLP-1R抑制剂组细胞内Ca2+-ATP酶、Na+-K+-ATP酶活性降低(P< 0.05)。见表1。
2.2.3 对心肌细胞μ -calpain mRNA表达的影响 与正常对照组相比, 缺氧高糖模型组μ -calpain mRNA表达量显著增加(P< 0.01); 与缺氧高糖模型组相比, 利拉鲁肽处理组μ -calpain mRNA表达量明显降低 (P< 0.01); GLP-1R抑制剂exendin(9-39)能抑制利拉鲁肽的上述作用(P< 0.05); 而利拉鲁肽对照组、高渗对照组与正常对照组相比差异无统计学意义 (P> 0.05, 图1)。
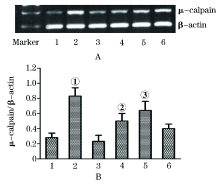 | 图1 利拉鲁肽对缺氧和高糖状态下心肌细胞μ -calpain mRNA表达的影响(n=3; A.电泳图; B.数据图。1.正常对照组; 2.缺氧高糖模型组; 3.利拉鲁肽对照组; 4.利拉鲁肽处理组; 5.GLP-1R抑制剂组; 6.高渗对照组。与正常对照组比较, ①P< 0.01; 与缺氧高糖模型组比较, ②P< 0.01; 与利拉鲁肽处理组比较, ③P< 0.05 |
2.2.4 对心肌细胞caspase-3活性和细胞凋亡率的影响 与正常对照组相比, 缺氧高糖模型组细胞caspase-3活性及凋亡率显著升高(P< 0.01), 利拉鲁肽对照组和高渗对照组细胞无明显变化(P> 0.05); 与缺氧高糖模型组相比, 利拉鲁肽处理组细胞caspase-3活性及凋亡率显著降低(P< 0.01); 与利拉鲁肽处理组相比, GLP-1R抑制剂组细胞caspase-3活性及凋亡率升高(P< 0.05, 表2)。
| 表2 利拉鲁肽对缺氧高糖状态下心肌细胞caspase-3活性和凋亡率的影响(n=6; |
在糖尿病患者中, 高糖和缺氧是临床常见的心肌损伤因素, 心肌缺血等心血管疾病导致的死亡占糖尿病患者死亡的50%以上[9]。因此, 本实验模拟糖尿病病变过程中心肌细胞的缺氧和高糖状态, 采用原代培养的心肌细胞作为干预的靶点, 对预防和延缓糖尿病心肌病具有指导意义。
在高血糖状态下, 缺氧和细胞内过多的葡萄糖可通过多种通路致使细胞损伤[10, 11], 这些代谢通路均可产生活性氧, 大量氧自由基可使细胞膜脂质过氧化, 使细胞膜通透性增强, 引起细胞外钙离子大量内流; 并导致膜上Na+-K+-ATP酶失活, 钠钙交换增强, 细胞内钙离子升高[12], 导致细胞内钙超载。钙离子是胞浆内重要的第二信使, 是多条信号传导通路的共同交汇点, 在多途径信号转导中起中心调节作用。细胞内钙超载, 会使细胞信号传导异常, 进一步导致物质代谢和能量代谢障碍[11]。本研究发现, 在缺氧和高糖的双重刺激作用下, 缺氧高糖模型组细胞内ROS水平显著增加, 钙离子浓度急剧升高, Ca2+-ATP和Na+-K+-ATP酶活性显著降低, 提示心肌细胞在缺氧和高糖双重刺激下处于钙超载状态。利拉鲁肽是一种长效的GLP-1类似物。近年来, 多项基础研究和临床试验证实, 利拉鲁肽对大鼠心肌缺血再灌注损伤有保护作用, 可缩小心肌梗死范围, 提高小鼠冠状动脉阻塞后存活率[13]。本实验观察到利拉鲁肽可抑制缺氧和高糖刺激下心肌细胞氧化应激水平和钙超载, 对心肌细胞具有保护作用。
钙敏感的钙蛋白酶(calpain)属于半胱氨酸蛋白水解酶超家族成员, 是一种特殊的蛋白水解酶, 其中研究最广泛的是calpain-1(μ -calpain), 在细胞内游离钙离子高水平时被激活。μ -Calpain的激活可引起心肌细胞凋亡效应分子(caspase-3, 9, 12)的级联反应, 导致细胞凋亡的发生[14]; μ -calpain激活caspase-3, 活化的caspase-3水解钙蛋白酶抑制蛋白(calpastatin), 使calpain活性增加, 促进细胞的凋亡[15]。Carpi等[16]报道心肌细胞钙超载时, 线粒体膜电位降低的同时伴随着calpain活性的上调。在半胱氨酸蛋白酶介导的细胞凋亡过程中, caspase-3是凋亡途径下游中进行底物酶解的关键蛋白酶, 是凋亡的效应分子和执行者[17]。有研究指出, 在缺血心肌组织内caspase-3高度表达, 而降低caspase-3活性的干预均可减轻心肌细胞的凋亡程度。本实验结果显示, 利拉鲁肽可通过抑制心肌细胞μ -calpain基因的表达, 降低caspase-3水平, 降低细胞凋亡率。而GLP-1R抑制剂exendin(9-39)可拮抗利拉鲁肽的上述作用, 由于利拉鲁肽通过与广泛分布于全身多个器官和组织的GLP-1R结合而发挥生物学效应, 提示利拉鲁肽抑制心肌细胞钙超载和凋亡的机制可能与GLP-1R通路相关。
综上所述, 利拉鲁肽能够降低缺氧和高糖所致的心肌细胞氧化应激水平, 抑制钙超载和μ -calpain基因的上调, 降低caspase-3水平和细胞凋亡率, 从而对心肌细胞发挥保护作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|


