作者简介:王一丞,硕士,医师。
肿瘤发生转移是胃癌患者死亡的一个重要因素, 这个过程通常伴有特定细胞因子和细胞信号转导通路的变化, 因此对胃癌发生、转移过程中相关细胞因子和细胞信号转导通路的研究将推动胃癌诊断与治疗技术的不断发展[1]。Rab25属于Rab蛋白家族的一种小GTP结合蛋白, 仅在肺、肾、胃肠黏膜等上皮组织中特异性表达, 功能上是一种运输蛋白, 在细胞内参与信号传导、细胞骨架形成、细胞内物质运输等重要过程[2]。最近研究表明, Rab25可影响胃癌细胞增殖、凋亡、迁移和侵袭, 调节肿瘤血管生成、能量代谢、整合素循环及参与上皮间质转化等多个过程[2], 而这一过程主要是由Rab25及其相互作用蛋白复合物共同完成的。因此, 明确胃癌细胞中Rab25的相互作用蛋白, 对胃癌的早期诊断、预后监测及靶向基因治疗有着重要意义。
以Rab25 cDNA为模板进行PCR扩增, 引物序列为:正向引物5'-CTGTACATGGGGAATGGAACTGAGGAA-3', 反向引物5'-AGAATTCTCAGAGGCTGATGCAACAGG-3'。PCR反应条件为:95 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 35个循环; 72 ℃延伸10 min。1%琼脂糖凝胶电泳鉴定并回收目的片段, 用BsrGI和EcoRI分别双酶切目的片段和FUGW-StrepII-6His-EGFP载体。酶切产物胶回收后16 ℃连接过夜, 连接产物转化DH5α 感受态细胞, 挑选阳性克隆进行测序验证后获得FUGW-StrepII-6His-EGFP-Rab25质粒。
为获得稳定表达StrepII-6His-EGFP-Rab25融合蛋白(实验组)和StrepII-6His-EGFP融合蛋白(对照组)的胃癌细胞, 将生长旺盛的SGC7901细胞接种于24孔板(4× 104/孔), 待细胞密度生长到60%左右时, 更换新鲜Dulbecco’ s Modified Eagle Medium (DMEM)完全培养液并加入含有StrepII-6His-EGFP-Rab25或StrepII-6His-EGFP序列的慢病毒颗粒, 感染36 h后将细胞移入6孔板中继续生长, 72 h后用流式细胞仪分析表达EGFP细胞的百分比。
收集3× 107个细胞, 用预冷的PBS缓冲液清洗细胞2次, 向细胞中加入1 ml预冷的细胞裂解液, 液氮反复冻融3次, 10 kg离心15 min, 收集上清液并用0.45 μ m滤器过滤备用。将上清液与100 μ l anti-StrepII beads在4 ℃孵育结合4 h, 用细胞裂解液洗去未结合的杂蛋白。用1 ml洗脱液在4 ℃洗脱anti-StrepII beads 2 h, 1000 g离心5 min, 收集洗脱液。将洗脱液与100 μ l anti-6His beads在4 ℃孵育结合2 h, 用细胞裂解液洗去未结合的杂蛋白, 将结合在anti-6His beads上的蛋白复合物-80 ℃冻存备用。
使用200 μ l含有100 mM碳酸氢铵溶液清洗结合有蛋白复合物的anti-6His beads, 1000 g离心去上清。加入100 μ l 10 mol/L二硫苏糖醇溶液作用30 min, 随后加入100 μ l 200 mM碘乙酰胺避光作用45 min, 最后加入1 μ g胰酶37 ℃酶切24 h。将酶切产物10 kg离心10 min, 取含有肽段的上清进行质谱鉴定。质谱分析采用UltiMate 3000纳升液相色谱+Bruker maxis 4G UHR-TOF质谱仪进行检测。10 μ l的样品进入戴安C18柱(75 μ m× 15 cm, 3 μ m, 100 Å )进行浓缩和快速除盐, 分析柱用以下梯度进行梯度洗脱:5~65 min乙腈浓度从5%上升至35%, 65~75 min乙腈浓度从35%上升至80%, 并在80%保持5 min, 75~90 min乙腈浓度返回到5%, 纳升泵流速控制在350 nl/min。肽段梯度洗脱后经纳升电喷雾系统(ESI)进入质谱分析仪进行蛋白质鉴定, 其中毛细管电压为1800 V, 扫描模式为Auto MS/MS, 扫描范围为50~1500 m/z, 扫描速率为4 Hz, 质量误差为± 0.05 Da。
将1× 107的SGC7901细胞用预冷PBS洗涤2次, 加入1 ml的IP细胞裂解液(Beyotime公司)冰上裂解30 min, 然后12 kg, 4 ℃离心15 min, 收集上清液并测定蛋白浓度。取500 μ g蛋白样品, 加入1 μ g和免疫沉淀时使用的IgG种属相同的普通IgG及20 μ l充分重悬的Protein A + G Agarose以降低背景, 4 ℃缓慢摇动1 h, 1000 g离心5 min后收集上清。在上清中加入1 μ g用于免疫沉淀的一抗, 4 ℃缓慢摇动孵育过夜, 次日加入20 μ l充分重悬的Protein A + G Agarose, 4 ℃缓慢摇动孵育4 h。1000 g离心5 min后去除上清, IP细胞裂解液洗涤5次, 加入20 μ l电泳上样缓冲液, 煮沸处理5 min, 离心后取部分样品进行分析。
在结合有Rab25蛋白复合物的anti-6His beads中加入50 μ l 蛋白上样缓冲液, 煮沸5 min, 1000 g离心5 min后收集上清。20 μ l上清液进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离, 100 V电泳2 h。采用Bio-Rad的标准湿式转膜装置在冰浴, 100 V, 2 h条件下将蛋白转移至PVDF膜。5%的脱脂奶粉封闭2 h后加入一抗, 4 ℃过夜孵育; TBST漂洗3次, 加入二抗孵育1 h, TBST洗涤3次, ECL化学发光, Bio-Rad成像系统显影。
采用Roche公司的X-tremeGENE siRNA Transfection Reagent进行siRNA转染实验, Rab25及Itgb1干扰序列购买至Invitrogen公司。将生长旺盛的SGC7901细胞接种到6孔板中(2× 105/孔), 待细胞密度生长到50%左右时进行转染实验。按照转染试剂说明书将siRNA及转染试剂混合物加到6孔板中, 转染体系为200 μ l, siRNA终浓度为100 nmol/L。72 h后收集细胞并采用Western Blot实验检测干扰效果。
采用Corning公司Transwell小室侵袭模型, 并用Matrigel进行包被。6孔板下室加1 ml含有10%胎牛血清的培养液, 上室中加入200 μ l细胞悬液(1.0× 105/ml), 培养36 h后取出, PBS洗膜后刮除上室底部基质胶, 4%多聚甲醛固定, 0.1%结晶紫染色10 min, 显微镜下计数侵袭细胞数量。每张膜取5个视野, 每组重复3次。
本实验结果采用SPSS13.0软件进行统计分析, 计量资料采用
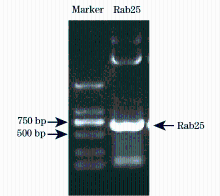
以Rab25 cDNA为模板, PCR扩增Rab25 CDS区片段(642 bp), 将产物进行1%琼脂糖电泳并回收(图1)。用BsrGI和EcoRI分别将PCR片段及目的载体FUGW-StrepII-6His-EGFP双酶切, 然后进行连接获得FUGW-StrepII-6His-EGFP-Rab25质粒, 测序结果提示构建成功。 通过磷酸钙沉淀法, 成功将慢病毒表达及包装质粒FUGW-StrepII-6His-EGFP-Rab25、psPAX2和pMD2.G共转染至293T细胞, 获得重组慢病毒颗粒, 随后将慢病毒颗粒感染SGC7901细胞, 获得稳定表达StrepII-6His-EGFP-Rab25融合蛋白的细胞。以EGFP为标记进行流式细胞分选, 分选后检测细胞表达融合蛋白阳性率为99.3%(图2)。
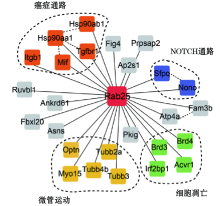
2.2 Rab25相互作用蛋白鉴定及功能分析基于TAP-MS连用技术检测Rab25相互作用蛋白, 3次重复实验数据利用Mascot软件收索Swiss-Prot数据库共鉴定出215个蛋白。进一步通过阴性对照排除杂质蛋白影响后, 选取在3次重复检测中出现2次的蛋白, 并按照Mascot分数、匹配的片段数和覆盖率等进行综合评定, 最终获得可信度相对较高的26个相互作用蛋白(表1)。通过收索BIND、HPRD、BioGRID蛋白质相互作用数据库, 确定26个蛋白之间的相互作用关系, 构建了以Rab25为中心的蛋白质相互作用网络(图3)。并采用DAVID在线分析系统进行基因注释分析, 根据生物学途径注释聚类分析表明这26个相互作用蛋白主要富集在癌症通路、微管运动、细胞凋亡及NOTCH通路上(图3)。
| 表1 胃癌细胞中Rab25的相互作用蛋白 |
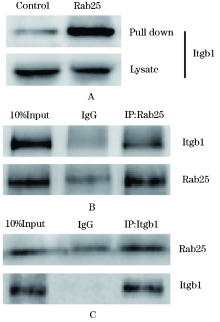
通过检测亲和纯化后Rab25相互作用复合物中的Itgb1, 证明Rab25和Itgb1相互作用明显(图 4A)。随后采用免疫共沉淀方法验证Rab25和Itgb1在SGC7901细胞中的内源性结合, 结果证明Rab25和Itgb1存在内源性相互作用(图 4B-C)。
通过特异性siRNA干扰, 我们成功抑制SGC7901细胞内Rab25和Itgb1的表达(图5)。采用Transwell试验评估干扰Rab25和Itgb1后对SGC7901细胞侵袭作用的影响, 结果显示, 无论是干扰Rab25或Itgb1都明显抑制细胞的侵袭能力, 同时干扰两种蛋白后抑制细胞侵袭能力作用更加明显(图6)。
3 讨 论蛋白质是有机体的重要组成成分, 是细胞功能的主要执行者, 且主要是通过蛋白质-蛋白质相互作用的方式发挥其功能特性。通过蛋白质组学研究和胃癌相关的蛋白质相互作用网络, 将能更好地阐明胃癌发生、发展及转移机制, 有利于解决胃癌的早期诊断和靶向治疗问题。
本研究利用高效的Strep-6His串联标签标记Rab25蛋白, 通过亲和纯化联合质谱检测的方法, 筛选获得26个相对可靠的相互作用蛋白质。运用生物信息学手段对筛选的相互作用蛋白进行基因注释分析, 结果表明这些蛋白主要定位在肿瘤相关通路、微管运动、细胞凋亡及NOTCH通路上, 而这些信号通路在细胞生长、增殖、分化及肿瘤发生过程中发挥重要调节作用, 强烈提示Rab25与肿瘤的发生发展密切相关。肿瘤相关通路中的Hsp90aa1和Hsp90ab1是蛋白进行正确折叠的重要分子伴侣, 其功能异常导致多种肿瘤发生, 其高表达将导致胃癌细胞浸润并直接影响患者预后[3]; Tgfbr1和Mif的表达程度和胃癌细胞浸润、淋巴结转移及TNM分期呈正相关, 此外也可能与幽门螺杆菌感染导致的胃癌密切相关[1, 4]。
细胞凋亡信号通路异常与胃癌的发生也存在密切相关, 高表达Brd2、Brd3的胃癌患者总体生存率明显下降, 这可能和其调控细胞染色质乙酰化密切相关[5]; Irf2bp1可通过增强泛素化进程调控胃癌相关基因的转录活性, 进而调控细胞的凋亡[6]; Acvr1属于TGF-b超家族成员, 在调节胃癌细胞生长上发挥重要作用[7]。研究表明, NOTCH信号通路与胃癌细胞分化、凋亡、增殖密切相关, Sfpq和Nono作为该通路中的两个重要蛋白, 能够相互作用形成异二聚体增强断裂DNA重新修复, 其缺失将导致S期细胞的异常积累而导致癌症的发生[8]。此外, Optn、Myo15、Tubb2a、Tubb3和Tubb4b主要参与了微管相关运动, 这也与Rab25介导囊泡转运的基本功能相关。
研究表明, Itgb1作为整合素家族的重要成员, 通过促进基质金属蛋白酶的分泌和活化, 降解细胞外基质, 在多种肿瘤的侵袭和转移过程中起到重要作用[9]。肿瘤细胞中过表达Rab25将加快细胞膜上整合素回收, 导致肿瘤细胞的侵袭和转移[10]。这些研究提示Rab25和Itgb1可能在胃癌细胞的生物学功能上存在联系, 而质谱结果也表明Rab25和Itgb1有可能有相互作用。为了进一步确认数据的可靠性, 我们通过免疫共沉淀实验证明了Itgb1和Rab25相互作用的真实性, 并通过Transwell试验证实了Rab25和Itgb1协同促进胃癌细胞侵袭。
本研究为深入了解Rab25及其相互作用蛋白在胃癌中的作用机制提供新的思路和方法, 以期为胃癌的治疗提供理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|