作者简介:王岚,硕士,副主任医师。
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody, ANCA )相关性血管炎(ANCA-associated vasculitis, AAV)分为3类, 即显微镜下多血管炎(microscopic polyangiitis, MPA), 肉芽肿性多血管炎[granulomatosis with polyangiitis, GPA, 原称为韦格纳肉芽肿(wegener granulomatosis, WG)]及嗜酸细胞性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA , 原称为Churg-Strauss综合征)。临床表现复杂多样, 可累及多个系统, 误诊率和病死率较高 [1]。近期, 我科收治1例入伍仅3个月的新兵GPA, 以肺部病变误诊为肺结核。为此, 我们总结诊治经过以加强对GPA早诊断、早治疗重要性的认识。
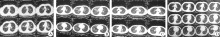
患者, 男, 21岁, 战士。因“ 鼻塞、流涕2个月, 咳血20 d” 于2013-04-15入院。2013年2月中旬无明显诱因出现鼻塞、流血水样涕、间或脓涕, 偶伴干咳、咽痒。3月底咳嗽加重, 出现痰中带血丝、咯血, 伴胸闷、明显乏力、低热(体温37.8 ℃左右)、盗汗、游走性关节痛, 4月15日就诊我院, 行肺部CT示双肺多发斑片及絮状渗出密度影, 边界欠清(图1A), 遂以“ 双肺结核” 收住感染科。患者入伍前体健。
入院时查体:体温37.0 ℃, 营养一般, 口唇无发绀, 双肺呼吸音粗, 未闻及干湿性啰音及胸膜摩擦音。入院后血常规示血红蛋白135 g/L、嗜酸性粒细胞绝对计数0.52× 109/L, 尿蛋白阴性、尿潜血1+, 便隐血阴性, 红细胞沉降率22 mm/h, C反应蛋白15.66 mg/L, D-二聚体236 μ g/L, 结核抗体阳性, 肝肾功能正常。入院后给予口服乙胺丁醇(750 mg, 1次/d, )、吡嗪酰胺(750 mg, 1次/d)、利福平(450 mg, 1次/d)、异烟肼(300 mg, 1次/d)及静脉点滴左氧氟沙星(0.3 g, 1次/d)治疗, 4月30日咳嗽、咯血痰症状消失, 出现恶心、纳差、游走性关节肿痛。当时考虑药物不良反应, 遂停用吡嗪酰胺, 关节疼痛一度好转, 但精神、食欲仍差。5月7日出现腹痛、腹泻, 对症治疗后症状仍反复出现。5月10日起密切监测血生化, 结果提示血红蛋白下降为92 g/L, 嗜酸性粒细胞绝对计数增至1.18× 109/L, 肌酐105.9 μ mol/L呈升高趋势, 尿蛋白多次阳性、同时出现红细胞及颗粒管型, 红细胞沉降率61 mm/h、C反应蛋白62.53 mg/L、D-二聚体1444 μ g/L均较入院增高。5月21日复查肺部CT示双肺斑片状密度影逐渐增多增大, 呈磨玻璃样变(图1B), 听诊双肺呼吸音弱, 尤以双下肺为著, 患者腹痛、纳差明显。医院组织呼吸消化、肾内、风湿免疫科院内会诊, 并逐步完善治疗方案。5月30日转入消化呼吸科, 予抗感染(罗氏芬+阿奇霉素)、对症营养支持等治疗。6月6日自身抗体检查回报类风湿因子(-)、抗核抗体(-)、抗环瓜氨酸抗体(-)、抗核提取物抗体谱(-)、抗双链DNA(-)、抗心磷脂抗体(-)、抗β 2糖蛋白Ⅰ (-)、抗肾小球基底膜抗体(-)、c-ANCA(+)、p-ANCA(-)、抗蛋白酶3(α -PR3)(+)> 200、抗髓过氧化物酶抗体(α -MPO)(-)、肿瘤系列(-)、T-spot(-)、支气管镜检及胃镜均示炎性改变, 请山西大医院风湿免疫科张莉芸医师会诊, 诊断为ANCA相关性血管炎。遂转入风湿免疫科, 予激素(甲强龙80 mg/d, 静脉点滴7 d, 之后改为强的松60 mg/d, 口服)、免疫球蛋白(20 g/d, 静脉点滴5 d)、环磷酰胺(0.4 g/2周, 静脉点滴)及营养支持、保肾等对症治疗, 患者症状明显改善, 分别于6月2日及6月12日复查肺部CT示双肺仍可见多发散在云絮状略高密度影, 边界欠清, 较前片明显减少, 密度减低, 右肺下叶外侧基底段可见斑点状高密度影(图1C、D)。肾活检病理:可见43个肾小球。肾小球毛细血管袢严重破坏, 其中4个细胞性、33个细胞纤维性、4个小细胞纤维性新月体形成, 部分包曼囊壁破坏伴球周围肉芽肿形成, 另2个肾小球系膜细胞和基质轻度增生。肾小管上皮空泡变性, 灶状刷毛缘脱落, 官腔扩张。肾间质多灶状淋巴和单核细胞浸润纤维化。小动脉管壁增厚。病理诊断:新月体性肾小球肾炎(Ⅲ 型)。结合抗PR3抗体阳性, 按照1990年美国风湿病学会(ACR)分类标准, 明确诊断为GPA。给予激素及环磷酰胺后, 患者肺部病变很快吸收, 在后续治疗中相继出现了高血压及双侧股骨头缺血坏死等并发症, 截至目前因肾脏受累严重, 肌酐波动于900~1000 μ mol/L, 仍在我院肾病科接受透析及对症治疗。
我国ANCA相关性血管炎以MPA为主, 占80%, GPA占20%, 而EGPA则相对少见[2, 3]。虽然ANCA相关性血管炎可见于各年龄组, 但50%的患者为65岁以上的老年人, 40~50岁是GPA的高发年龄[4]。典型的GPA有三联征:上呼吸道、肺和肾病变。以上呼吸道病变为首发症状者, 通常表现为持续性流涕、不断加重、伴鼻出血、涎液中带血丝等慢性鼻炎及副鼻窦炎症状; GPA的肺部受累常以胸闷、气短、咳嗽及咯血为主要症状, 肾脏受累多表现为蛋白尿, 红、白细胞及管型尿和肾功能异常。由于GPA临床表现多样, 还可累及眼、皮肤、神经及关节等部位, 患者常有不规则发热、疲乏、关节肌肉疼痛和体重下降等非特异性症状; 影像学可以表现为弥漫性毛玻璃影、结节影、弥漫性间质病变, 也可呈局灶性病变, 如大小不等的结节、空洞或片状阴影, 常需要与肺结核、肺曲霉菌感染、肺出血-肾炎综合征、特发性肺含铁血黄素沉着症、肺部肿瘤及MPA、EGPA、复发性多软骨炎等相鉴别, 因此, ANCA的检测显得尤为重要, c-ANCA(抗PR3抗体)阳性主要见于GPA, p-ANCA(抗MPO抗体)阳性主要见于MPA和EGPA, 当然, 组织活检是确诊的金标准。
本例较年轻, 不属于ANCA相关性血管炎多发人群; 以呼吸系统症状起病, 非专科医师缺乏对本病的认识, 按惯性思维首先考虑肺结核, 治疗过程中, 逐渐累及血液、肾脏、关节、消化等多器官。经院内多学科会诊, 完善ANCA 抗体检测方明确诊断。确诊后前期经积极有效治疗, 肺部病变明显改善, 患者起病时虽无肾脏病变, 随病情进展逐渐发展成肾小球肾炎, 肾活检时已有较重肾小球硬化、纤维性新月体、间质纤维化等不可逆的慢性化改变, 增加了发生慢性肾衰竭的风险, 同时合并了高血压及双侧股骨头缺血坏死, 目前依靠血液透析维持治疗。医师应全面了解该疾病可造成的多系统损害的临床表现, 早期识别, 早期检测ANCA, 以达到早期治疗, 改善患者预后的目的。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|