作者简介:温 宁,博士,主任医师。
恶性肿瘤是一种严重威胁人类健康的疾病[1]。美国癌症协会最新数据显示, 在美国, 目前恶性肿瘤为第二位致死性疾病, 预计在未来几年将超过心血管疾病成为首位致死性疾病。2017年, 美国约有1.69万例恶性肿瘤新发病例, 60万例肿瘤死亡病例; 中国每天约有1万人确诊为恶性肿瘤, 每分钟有7人确诊为恶性肿瘤。如何有效控制、攻克恶性肿瘤已经成为一个亟待解决的重要公共健康问题[2, 3]。
恶性肿瘤传统的治疗方式以外科手术、放射线治疗及化学药物治疗为主, 以上三种治疗手段至今仍是临床一线治疗方式。虽然传统抗肿瘤药物可延长部分患者生命, 然而也遇到诸多挑战, 如药物半衰期短、生物利用度低、易耐药、非特异性分布、难穿过生理屏障等。因此, 迫切需要研发新型治疗方法克服上述困难, 纳米药物便是其中之一。
纳米(nanometer, nm)是一个长度计量单位(1 nm=10-9m), 1 nm约等于三个原子排列的宽度或脱氧核糖核酸(DNA)双螺旋结构的半径。纳米粒(nanoparticles, NP)亦被称作超微颗粒, 是指粒径大小介于0.1~1000 nm的超微粒子结构, 具有表面活性中心多、反应活性高、催化效率高、吸附能力强等优良特性, 在许多领域展示出广阔的应用前景。
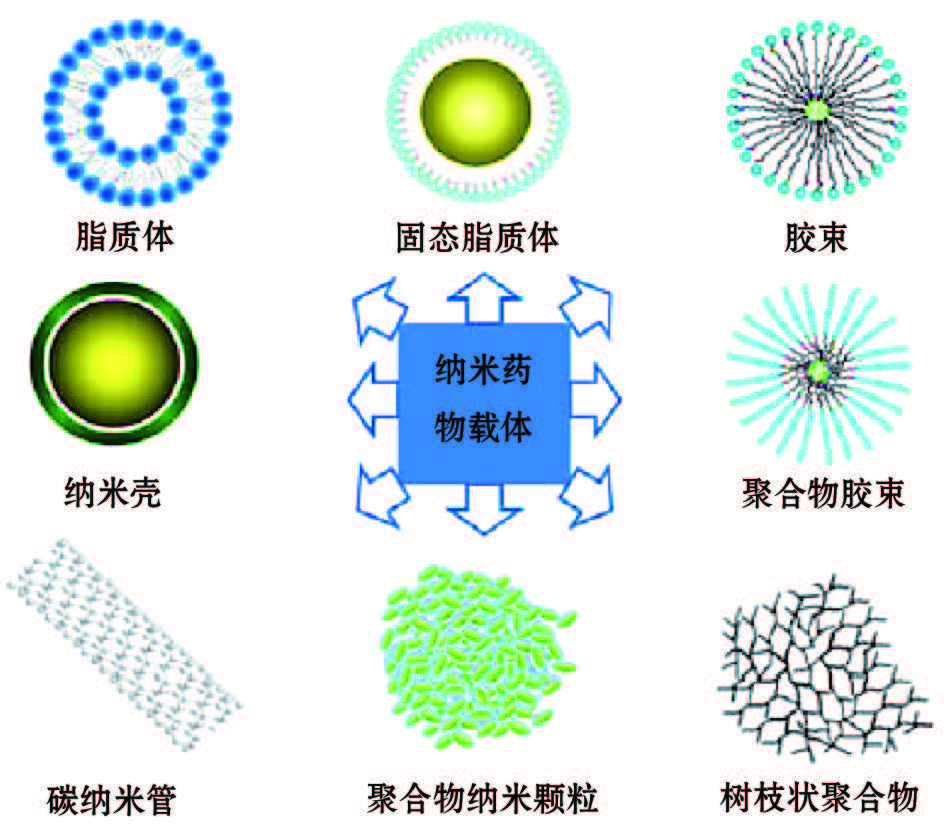
是指运用纳米技术制造的, 粒径在1~1000 nm的药物及载药系统, 主要分为药物纳米粒子和纳米载药系统两大类。药物纳米粒子的实质是微粉化技术、超细粉技术的发展, 在表面活性和水等附加剂的存在下, 直接将药物加工至纳米粒而制得[5]。纳米载药系统是指吸附、结合、溶解或分散药物的多种纳米粒。在纳米药物中, 发展较快, 报道较多的是纳米载药系统, 主要包括以下类型:纳米脂质体、固体脂质纳米粒、纳米乳、聚合物纳米粒载药系统、聚合物纳米胶束载药系统及树状聚合物等[6] (图1)。纳米药物的出现是纳米技术研究领域与生物医学研究领域的完美结合, 为肿瘤治疗提供了新的策略和更多的选择。
主要包括以下几点[7]:(1)传统药物经纳米化后, 药物本身的理化性质(如稳定性、可溶性、半衰期等)得到明显改善; (2)减少药物不良反应, 改善药物治疗综合评价指标; (3)可设计为触发响应型药物释放系统; (4)易于对生物大分子药物(DNA, siRNA, mRNA和蛋白等)完成细胞内的生物递送; (5)可以实现组织靶向、细胞靶向甚至分子靶向的药物特异性递送模式; (6)实现多种药物同时递送, 利用药物协同作用, 提高纳米药物疗效, 重点克服耐药; (7)纳米技术可帮助载药系统顺利通过生理屏障(如胃肠道和血-脑屏障等); (8)提供更为敏感的诊断和显像功能。在疾病治疗过程中, 可将治疗药物与成像探针结合, 实时反馈体内分布, 最终实现药物递送地点可视化。
纳米药物的自身特性, 如缓慢释放药物、延长药物半衰期、提高生物膜透过率、提高制剂的载药量等奠定了其在肿瘤治疗中的诸多优势。
值得注意的是, 纳米药物在肿瘤治疗中的成功应用, 除了上述自身优势外, 还与肿瘤病理生理特点有关。正常组织的微血管内皮细胞连接紧密、间隙致密、结构完整, 大分子类物质不易透过血管壁。但在实体瘤组织中, 特别是当肿瘤直径增长至1.0~2.0 mm时, 肿瘤血管快速无序增殖, 产生血管形成因子(angiogenesis factor)和毛细血管渗透因子(capillary-permeabilizing factors), 以便获得足够的营养物质和氧气, 使得肿瘤组织内血管丰富、血管壁间隙较宽、连续性结构完整性差、血管通透性高; 另外, 肿瘤组织中淋巴系统受损, 淋巴回流缺失, 无法滤过高分子物质。因此, 使得血液循环中的大分子物质容易渗透进入肿瘤组织并长期滞留, 此现象被称为实体瘤的“ 高渗透长滞留效应” (enhanced permeability and retention effect, EPR), 简称EPR效应[8]。具有EPR效应的纳米药物对肿瘤组织的靶向效应更加明显, 能够显著提升药物的抑瘤效果并大大降低药物毒性及不良反应, 很大程度弥补了传统抗肿瘤药物的不足, 有望成为临床肿瘤治疗的新策略。
随着研究的不断深入, 无论是纳米载药系统还是被装载的纳米药物均有了长足的发展, 同时也遇到一些问题和挑战。
是第一批获得临床批准并应用于肿瘤治疗的纳米载体。尽管将不同抗肿瘤药物封装在脂质体内可以在一定程度上改善药代动力学和生物分布, 但就目前上市的脂质体纳米药物来说, 与单纯被装载的药物相比, 尚不能显著提高总生存率。
是一个正在进行三期临床试验的纳米载药系统, 用于治疗高危急性髓系白血病。与本体药物相比, 纳米载药系统组的总生存时间由5.95个月提高到9.56个月, 成为脂质体纳米载体系列药物中的重大突破[14, 15]。
是第二种商品化的纳米药物, 以白蛋白纳米颗粒为载体可以实现大剂量疏水型药物的装载, 有效地替代了溶解疏水药物所必须的有毒药剂, 从而使疏水药物在高剂量, 更快速的全身给药过程中, 人体仍然可以保持良好的耐受。从效果来看, 与单纯紫杉醇相比, 静脉注射Abraxane后, 该纳米药物能够迅速释放白蛋白和紫杉醇入血, 但药代动力学和体内分布情况无明显差异。尽管每周3次方案使纳米药物在响应速率和乳腺癌无疾病进展时间这两个方面优于单纯的紫杉醇, 但是每周1次方案在无疾病进展时间以及总生存时间与单纯紫杉醇治疗并无明显差异, 反而增加了毒性反应[16]。
聚合物胶束(如Genexol-PM, NK105)及聚合物纳米颗粒(CRLX101, BIND-014, AZD02811 Accurin)是新型抗肿瘤纳米药物。
上述几种纳米药物的临床试验结果却让研究者们略感失望。这使研究者们不得不重新思考继续研发该类产品的策略, 包括患者的合理选择及如何合理用药等方面[17]。以铁氧化纳米颗粒为载体的无机纳米材料(金纳米棒, 铁氧化纳米颗粒)也显示出了一定的抗肿瘤潜能, 特别是在胶质瘤的治疗方面取得了一定的突破。此外, 结合肿瘤的分子生物学特性, 纳米载体内包载的药物也从传统的化疗药物, 逐渐向热疗、放疗、基因治疗及免疫治疗发展。更多肿瘤特异性靶点的加入, 使抗肿瘤纳米药物的研究趋于精准化和多元化, 为肿瘤治疗提供更为广阔的思路和策略。
纳米技术凭借其独有的生物学特性, 在药物代谢领域、疾病诊断和影像学研究领域、综合疫苗开发领域、微型医疗设备领域, 以及重大疾病治疗等领域均崭露头角, 呈现出良好的应用前景。特别是在肿瘤治疗方面, 大批的抗肿瘤纳米药物正处于临床研究阶段。纳米-生物相互作用以及纳米药物载体的研究进展十分迅速。一个很有趣的现象是, 在PubMed上刊登的与“ 纳米颗粒” 相关的文献在2000年-2014年期间以每2年增加1倍的速度发表。其增长速度甚至超越了20世纪80年代“ 单克隆抗体” 的相关文献报道。单克隆抗体的临床转化工作是相当成功的, 因此人们期待纳米药物也能够和单克隆抗体一样, 在抗肿瘤领域有着不俗的转化成果。
在肯定机遇的同时, 我们也意识到了挑战。能否基于肿瘤的复杂性、异质性等特点, 严格选择适应症患者, 使其能够最大限度的受益于纳米治疗, 达到精准治疗的目的。人们所期待的抗肿瘤纳米药物或靶向某个基因或某个分子进行特异性修饰和优化, 或者根据个人的基因测序结果进行设计, 形成个性化专一的药物治疗方案, 这才是未来治疗肿瘤的趋势。相信随着纳米技术的不断创新和进步, 材料的选择和制备工艺也将不断优化, 纳米材料的生物安全性会得到更大改善, 纳米材料在人体内的代谢和分布将变为可控因素, 生物相容性将会得到进一步提高。新型具有优良性能的纳米药物和基因载体必将涌现, 为肿瘤等难治性疾病的治愈提供新的途径。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|