目的 通过原子力显微镜(atomic force microscopy,AFM)观察人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)表达的乳腺癌细胞膜的表面形态变化,为提高乳腺癌HER-2检测的敏感性和精确性提供新方法。方法 利用AFM分别观察不同组织学类型的人类表皮生长因子受体抗体阳性表达和阴性表达的乳腺癌细胞膜表面形态特征并对特征参数平均粗糙度、平均峰高度、平均凹陷深度和表面积差值进行定量测量,采用统计学方法进行差异性分析。结果 HER-2阳性表达组的乳腺癌细胞形态和阴性表达组相比具有明显的不同:HER2阴性表达的乳腺癌细胞膜隆起较“尖锐”,隆起物高且偏细,每个单倍计数面积内的隆起物数目较多;而HER2阳性表达的乳腺癌细胞膜隆起较“粗大”,隆起物低且偏粗,每个单位计数面积内的隆起物数目明显减少。两组细胞在平均粗糙度[(21.87±2.46)/(32.65±1.03), P<0.000]、平均峰高度[(13.94±1.01)/(31.15±3.89), P<0.001]、平均凹陷深度[(11.09±6.36)/(33.58±3.15), P<0.001]和表面积差值[(6.27±2.03)/(19.65±1.13), P<0.001]方面具有明显差异( P<0.05)。不同组织学类型的乳腺癌细胞膜表面形态变化趋势与此一致。结论 细胞膜表面结构因细胞功能状态的不同而不相同。相同肿瘤细胞在不同功能状态下,其细胞膜在形态结构上存在很大的差异,这为探讨肿瘤的发生机制、发展过程和早期诊断及细胞诊断提供依据,为提高HER-2的阳性率诊断提供新方法。
Objective To observe the morphological changes in the surface of breast cancer cell’s membrane with different expressions of human epidermal growth factor receptor-2 under the atomic force microscope(AFM)in order to provide a new method for improving the sensitivity and accuracy of HER-2 detection in breast cancer and stimulate new ideas for early diagnosis of tumor at the sub-cellular level.Methods Beast cancer cells of different histological types were divided into two groups based on their expression levels of human epidermal growth factor receptor-2: the positive group and negative group. The surface morphology of cells’ membrane was observed with atomic force microscopy respectively. Such characteristic morphological parameters as average roughness,mean peak-height,average maximum depth and surface area difference of these cells were quantitatively measured ,and the results were statistically analyzed.Results There was significant difference between the two groups in cellular morphology. The surface of positive cell membrane of human epidermal growth factor receptor-2(HER-2) was rough and uneven, and the tuberositas was high and thin, but the tuberositas was heavy and wide in the HER-2 negative group.There were more tuberosities in the positive group than in the negative group in each count area.The difference in morphological characteristics between the two groups was obvious in the average roughness[(21.87±2.46)/(32.65±1.03), P<0.000],mean peak-height[(13.94±1.01)/(31.15±3.89), P<0.001], average maximum depth[(11.09±6.36)/(33.58±3.15), P<0.001]and surface area[(6.27±2.03)/(19.65±1.13), P<0.001].Conclusions The surface structure of cell membrane varies with different functional states, which may give us an insight into the mechanism, development and early diagnosis of cancer. It could also provide a new method for the diagnosis of the positive rate of HER-2.
乳腺癌是危害女性健康的主要恶性肿瘤之一。近几年来, 我国乳腺癌的发病率以每年3%的幅度逐年上升[1], 并且呈现年轻的趋势。有数据显示, 目前北京、上海等地区乳腺癌的发病率高达30/10万, 在女性恶性肿瘤中居第一位, 成为威胁女性健康和生命的主要疾病[2]。大量研究表明, 定位于染色体17q12-21.32上的HER-2基因, 即HER-2基因的过度表达在乳腺癌细胞增殖方面起重要作用, 与肿瘤患者的病情发展、肿瘤转移及患者生存期的长短有关, 并且还与患者对化疗和内分泌治疗的耐药性有关, 是独立的不良预后因素。但是, HER-2的表达状态的改变是如何体现在肿瘤的细胞膜上的?为什么不同HER-2表达状态的肿瘤对治疗的反应不同?在肿瘤的形态结构上有什么与之相对应的结构改变?目前尚未见此方面的报道。
AFM作为20世纪80年代发展起来的一项新技术[3, 4], 与传统的扫描电子显微镜相比, 它具有很高的横向和纵向分辨率。随着纳米医学的发展, AFM于20世纪90年代后期开始成功地应用到生命科学领域的研究[5, 6, 7], 利用其精密的分辨率, 可以清晰地观察细胞乃至细胞膜的结构形态, 成功地获取细胞膜的形态并测量其相关特征参数。从而观察肿瘤细胞的改变和不同, 为其不同的生物学特性和治疗提供形态学的证据。本研究利用AFM的这些优势来达到预期的目的。
选取我院病理科2013-07至2014-07接收到的新鲜乳腺癌切除标本, 共计53例。其中, 男4例, 女49例, 18~76岁, 平均(38.64± 4.16)岁。乳腺浸润性导管癌32例, 黏液癌2例, 小叶原位癌13例, 其他类型6例。所有标本均经HE染色和免疫组织化学一步法染色后由3位以上高年资病理医师作出明确诊断。
(1)Nanoscope a型AFM(购自Digital InstrumentsInc, SantaBarbara, CA)(悬臂:氮化硅(Si3N4)悬臂; 针尖:NSC-Ⅱ 型, 曲率半径为20~30 nm; Tapping扫描模式, 即轻敲模式); (2)倒置相差显微镜(NIKONECLIPSETE2000-U, 日本NIKON公司)
空气湿度60%左右, 温度25 ℃左右。
1.4.1 印片法制备AFM的细胞观察样品 将收集的新鲜乳腺癌组织用洁净锋利的刀片剖开, 用吸水纸反复吸去剖面上的血迹、水分和组织液, 然后将预先用1%的甲醛溶液处理好的载玻片轻轻的按压于组织的剖面上, 力求使细胞均匀的印在玻片上。每个组织剖面印5张切片, 每个组织选择3个切面。将印好细胞的载玻片置于1%的甲醛溶液中固定20 min, 然后取出, 置于洁净的环境中晾干, 分组, 保存以备扫描。
1.4.2 分组 用免疫组织化学的EnVision法检测HER-2的表达, 并且根据其蛋白表达的强度进行评分(0、1+、2+、3+, 其中2+和3+视为阳性, 0和1+视为阴性)[8]。具体结果判读如下:(1)0, 完全没有着色或者少于10%的肿瘤细胞有细胞膜着色; (2)1+, 大于10%的肿瘤细胞呈现微弱、不完整的细胞膜着色; (3)2+, 大于10%的肿瘤细胞呈现弱至中度完整的细胞膜着色; (4)3+, 大于10%的肿瘤细胞呈现强的、完整的细胞膜着色[9]。
1.4.3 AFM扫描各组细胞样品 将样本置于AFM载物台上, 利用Nikon倒置显微镜选取合适的细胞区域(分散度较好、呈点状分布的区域), 调整激光光斑于显示器的中心位置, 选择自动调频, 自动下针以逐步靠近样本直至接触到样本并开始扫描。动态观察显示屏出现的细胞图像并随时调节扫描位置, 按照扫描由大到小的顺序逐步扫描单个完整细胞和细胞膜并获取图像。每张样品选取10个细胞, 每个细胞扫描范围介于35~500 nm之间。根据扫描需求在0.5~2.0 Hz调节扫描频率。扫描完成的细胞和获取的相应图像进行特殊定位和标记, 以备后续免疫组织化学染色进一步确认分组的准确性和目标细胞的正确性。扫描图像保存后用AFM分析软件进一步分析, 分别观察HER-2阳性组和阴性组细胞的细胞膜形态并对表面平均粗糙度、平均峰高度、平均凹陷深度和表面积差值等细胞膜形态参数进行定量测量。
1.4.4 免疫组织化学染色复核 将扫描完成的乳腺癌印片细胞进行HER-2受体的免疫组织化学染色, 由3名主治以上的病理医师读片确认病例分组的准确性, 并且根据定位, 确认每个扫描细胞的HER-2受体着色分组无误。
1.4.5 细胞膜表面参数定量分析 整理扫描范围为1 μ m区域的测量结果, 利用AFM图像分析系统对两组细胞的细胞膜形态参数进行定量测量。
实验所得到的各项数据应用SPSS 17.0统计软件进行分析, 各指标用
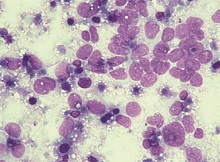
采用新鲜组织印片法获取的乳腺癌细胞样本经1%的甲醛溶液固定后细胞形态结构完整, 细胞膜、细胞核、核仁均清晰, 利于AFM的观察。印片法获取的细胞分布均匀, 重叠较少。在常规苏木精-尹红(HE)染色下, 细胞质红染, 细胞核、核仁着蓝色, 核仁位于细胞的中央或者偏于一侧(图1)。免疫组织化学一部法染色结果, HER-2阳性表达的病例有21例, 阴性表达的病例有32例; 其中, 浸润性导管癌(14例阳性; 18例阴性), 黏液癌(0例阳性; 2例阴性), 小叶原位癌(5例阳性; 8例阴性), 其他类型(2例阳性; 4例阴性)。
2.2.1 乳腺癌膜表面重要参数测量结果 两组(HER-2表达阴性组和阳性组)乳腺癌细胞膜在4个膜表面参数(最大峰高度、平均粗糙度、表面积差值和平均凹陷度)的比较上差异有统计学意义(表1)。
2.2.2 不同组织学类型的乳腺癌细胞膜表面重要参数测量结果 不同组织学类型的乳腺癌细胞膜的表面重要参数因HER-2的表达不同而差异具有统计学意义(表2)。
| 表1 不同HER-2表达的乳腺癌细胞膜表面平均峰高度、粗糙度、表面积差值和凹陷度(n=7950; nm; |
2.2.3 AFM扫描细胞成像三维图形 不同组织学类型、不同HER-2表达的乳腺癌细胞在较大扫描范围(40~30 μ m)下呈现细胞的完整结构, 细胞形状为球形/橄榄球形, 而随着扫描范围的不断缩小, 细胞膜的表面凹凸不平, 出现不同程度的隆起, 而隆起的形态因HER-2的表达不同而出现差异, 这种差异在不同组织学类型的乳腺癌细胞的规律相似, 即:HER-2阴性表达的乳腺癌细胞膜隆起较“ 尖锐” , 隆起物高且偏细, 每个单倍计数面积内的隆起物数目较多; 而HER-2阳性表达的乳腺癌细胞膜隆起较“ 粗大” , 隆起物低且偏粗, 每个单位计数面积内的隆起物数目明显减少。
| 表2 不同组织学类型及不同HER-2表达的乳腺癌细胞膜表面平均峰高度、粗糙度、表面积差值和凹陷度 (nm; |
随着近些年乳腺癌发病率和死亡率的明显增高, 探讨乳腺癌的发病机制, 寻找其早期精确诊断和预后判断的敏感指标, 从而探寻治疗的新靶点、新突破, 成为了当前乳腺癌研究的重点。1987年Slamon等[10]首先在乳腺癌细胞表面发现了HER-2。而后续的众多研究都进一步明确了其在乳腺癌的发生、发展、预后和治疗中的作用。
研究充分证实, HER-2能够通过各种信号转导途径影响细胞骨架的重建、细胞运动、细胞间黏附以及蛋白酶表达和激活[11]。其过度表达能够促进乳腺癌肿瘤的发生和恶性转化。体外研究证实, 转染HER-2基因的乳腺癌肿瘤细胞株DNA合成能力增强, 细胞生长速度加快, 侵袭性增强, 并且可以增强裸鼠的成瘤性和肿瘤的转移能力。众多的研究进一步表明, HER-2在判断乳腺癌的预后包括病理学类型、TNM分期以及癌组织中ER、PR水平表达中可以作为独立的指标[12, 13]。同时, HER-2的表达水平还影响临床中对乳腺癌患者手术方式的选择; 指导治疗方案的制定和预测治疗, 甚至可以作为肿瘤对内分泌治疗和化学药物治疗的预示指标。例如, HER-2过度表达提示预后不良, TNM分期为Ⅰ 期的患者可以行乳腺全切, 相反则可以选择保乳治疗[14]。
HER-2在乳腺癌的发生发展、治疗和预后的过程中具有举足轻重的地位。早期、精确、准确的测定其表达的特点, 有助于临床早期进行治疗的选择和不良预后的干预。HER-2作为细胞膜上的受体, 直观的观察和测定会更有说服意义。而AFM的发现, 为实现这一目标提供了可能。就针对乳腺癌的AFM研究, 2009年Plodinec等[15]利用AFM观察人乳腺癌细胞结合表皮生长因子抗体(HER-2)后细胞膜表面的变化, 结合荧光成像发现癌细胞的细胞膜在粗糙程度等方面有明显的变化并获得了变化的立体结构图像。2012年, Jin等[16]利用AFM发现骨形成蛋白(BMP2)通过改变细胞的支架和降低细胞的黏附来促进如下年息报的迁移和侵袭。而在国内, 陈勇和蔡继业[17]也利用AFM观察乳腺癌细胞外纤连蛋白原纤维空间分布和排列规律的形态学特征来探讨乳腺癌的转移机制。
在本研究中, 借助AFM观察细胞形态的优势, 笔者发现, 乳腺细胞在发生癌变后, 细胞膜的形态特征会发生变化, 在细胞膜形态参数的量值上具有明显改变。乳腺癌细胞膜的表面均呈现为不同程度的隆起, 而隆起的形状则因HER-2的表达状态不同而有明显差异(P< 0.05):HER-2阴性表达的乳腺癌细胞膜隆起较“ 尖锐” , 隆起物高且偏细, 隆起之间的间隔“ 沟壑” 较深, 每个单倍计数面积内的隆起物数目较多; 而HER-2阳性表达的乳腺癌细胞膜隆起较“ 粗大” , 隆起物低且偏粗, 隆起之间的间隔“ 沟壑” 较浅, 每个单位计数面积内的隆起物数目明显减少。 而对于不同组织学类型(浸润性导管癌、小叶原位癌、及其他类型的乳腺癌)的乳腺癌的细胞膜形态特征的变化趋势与整体相一致(均P< 0.05)。在本研究中, 因收集病例中黏液癌的数量过少, 数据统计不合理, 结论尚不明确。
分析乳腺癌细胞膜形态的这种变化, 是与其疾病的发生和进展相一致的。HER-2阴性表达的乳腺癌患者体内的基因尚未发生突变, 其癌细胞膜表面的受体结合位点较多, 在临床中选择基因靶向治疗药物的治疗意义不大, 相反, 因为有功能受体位点的存在, 选择受体拮抗剂(内分泌治疗)的治疗意义较大。HER-2阳性表达的乳腺癌患者体内的基因发生了突变, 其癌细胞的发生发展轨迹改变, 体现在癌细胞膜表面的受体结合位点减少, 功能降低甚至丧失。对于此类患者, 因基因改变的缘故, 对中晚期患者而言, 手术治疗和内分泌治疗意义有限, 而基因靶向治疗的选择就非常必要。
无论哪种类型癌症的治疗, 时机的选择非常重要, 而最关键的则在于早期诊断和早期治疗。尽管目前针对HER-2的检测方式非常多, 例如DNA水平上的PCR荧光原位杂交、显色原位杂交和非荧光原位杂交等以及蛋白质水平上的免疫组织化学检测法和酶标免疫法等, 但是任何一种检测方法均受到组织处理方法、固定时间、试剂等的影响, 其结果判读和解释中存在较大的变异。因此实际操作中, HER-2的检测结果敏感性和精确性都较低。相反, AFM值通过直接观察乳腺癌细胞膜上的形态特征, 组织来源于新鲜标本, 对于组织的处理和试剂的需求较少, 获得的结果是直观的可用数据说明的三维立体图像。结果真实、可靠、敏感是其区别于其他检查方式的特点。除此之外, AFM的测定对组织体积的需求较低, 穿刺组织、针吸细胞均可实现测定。因此可以提高早期对HER-2状态的发现, 结合后期其他技术方法的测定大大提高临床的HER-2检测准确性和敏感性, 为临床的治疗工作提高可靠的依据指导。
综上所述, AFM的发明和应用将在未来的医学中具有很大的价值, 尤其是现如今纳米医学、纳米诊断和纳米治疗环境下对疾病早期诊断和微小诊断的需求中, AFM具有得天独厚的优势。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|