目的 探讨血管内皮祖细胞(endothelial progenitor cell,EPC)对骨质疏松(OP)大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)自主脂肪化的影响。方法 选6周龄雌性 SD 大鼠,建立OP模型。体外分离、培养大鼠EPC、BMSC。分别取第3、6代BMSC及原代EPC,建立EPC/BMSC 间接共培养体系。实验分组:假手术组BMSC(BMSC sham)、OP组BMSC(BMSC ovx)、OP BMSC /EPC共培养组(BMSC ovx/EPC);MTT法检测细胞增殖情况;油红 O染色检测成脂分化情况,real- time PCR检测成脂分化标志物PPARγ2的mRNA表达水平。结果 BMSC ovx/EPC 组BMSC的增殖能力显著高于BMSC ovx组;BMSC ovx/EPC组自主脂肪细胞分化水平明显低于BMSC ovx组。结论 EPC可通过间接接触提高骨质疏松大鼠BMSC的增殖能力,并能有效抑制OP大鼠BMSC的自主脂肪化。
Objective To investigate the effect of endothelial progenitor cells (EPCs) on adipogenic differentiation of bone marrow mesenchymal stem cells (BMSCs) of osteoporosis rats in order to provide a new strategy for prevention and treatment of osteoporosis.Methods An osteoporosis animal model was established with six-week-old female SD rats. EPCs and BMSCs of these rats were cultivated and identified in vitro. BMSCs at passage 3 and 6 were used respectively to establish a BMSC-EPC indirect co-culture system on transwell inserts. The experimental groups included the BMSC sham group, BMSC ovx group and BMSC ovx/EPC indirect co-culture group. MTT assay was applied to measure the cellular proliferation while Oil Red O solution was used to detect lipid droplets within the cells. Real-time PCR analyses were performed to analyze the expression of adipogenic marker PPARγ2.Results Under indirect co-culture conditions, EPCs could significantly promote the proliferation of BMSCs(ovx) and greatly inhibit the cells’capacity of self-adipogenic differentiation. Co-cultured EPCs resulted in a better proliferative ability of BMSCs in the BMSC ovx/EPC group than in the BMSC ovx group. Furthermore, BMSCs in the BMSC ovx/EPC group had a lower self-adipogenic differentiation potential than in the BMSC ovx group, which was evidenced by Oil Red O staining quantification and mRNA expression levels of adipogenic marker gene PPARg2.Conclusions Under indirect co-culture conditions, EPCs can enhance the stem cells’ proliferation but notably inhibit autonomic adipogenic differentiation of BMSCs of osteoporosis rats.
众所周知, 增龄或绝经后的骨质疏松(osteoporosis, OP)患者, 其骨髓间充质干细胞(bone marrow mesenchymal stem cell, BMSC)会自发地向终末脂肪细胞分化, 导致骨髓脂肪化[1, 2]。因此, 如何逆转或抑制骨髓脂肪化, 增强BMSC的干细胞功能, 是近年来研究OP预防和治疗细胞学的新方向[3, 4]。自1997年发现血管内皮祖细胞(endothelial progenitor cell, EPC)以来, 已证实它具有形成新生血管、改善微环境等功能。近期有学者将EPC的这些生物学功能应用于干细胞的研究中, 并经初步证实EPC可以有效维护长期体外培养BMSC的干细胞功能特性, 提高正常或OP情况下BMSC移植后的骨修复功能[5, 6, 7]。因此, 利用EPC来促进OP环境下BMSC的活性和功能, 并以期达到有效抑制骨髓的自主脂肪化的效果, 在理论上是有充分依据的。本实验通过细胞间接共培养方式, 探讨EPC是否具有调节OP大鼠BMSC细胞活性和自主脂肪细胞分化的功能, 为绝经后OP的治疗提供新的实验依据。
6周龄雌性SD大鼠20只(原第四军医大学实验动物中心提供), 体质量200 g左右。Siemens Inveon Mirco-CT(μ CT, Siemens, 德国), α - MEM培养基(Gibco, 美国), EGM-2 BulletKit培养基(Clonetics, 美国), Dil标记的乙酰低密度脂蛋白(Dil-acLDL, L3484, Molecular probe, 美国), 异硫氰酸荧光素标记的荆豆凝集素I(FITC-UEA-I, FLl061, Vector, 美国), Transwell小室(Coming, 美国), 油红O(Sigma, 美国), 酶联免疫检测仪(Beckman-Coulter, 美国), 反转录试剂盒(PrimeScriptTM RT-PCR Kit, Takara, 日本)。
采用经典的卵巢去势法建立OP模型:将大鼠随机分为假手术组(sham 组)和去卵巢手术组( ovx 组), 每组10只, 术后增龄3个月, 显微CT(μ CT)扫描确定OP模型的建立。密度梯度法结合差速贴壁法培养大鼠BMSC并进行细胞鉴定。分步预接种法培养大鼠骨髓EPC[5]并进行细胞鉴定[5, 8]。7 d后收集EPC建立Tanswell(0.4 μ m孔径)BMSC ovx/EPC间接共培养体系。MTT法检测细胞的增殖及活性。油红O染色及酶联免疫检测仪检测细胞的成脂分化能力。Real-time PCR检测成脂基因的表达, 引物序列如下:β -actin 上游引物序列, 5'-CATGTACGTTGCTATCCAGGC-3'; 下游引物序列:5'-CTCCTTAATGTCACGCACGAT-3'(250 bp, NM_001101); PPARγ 2上游引物序列:5'-AGTGGAGACCGCCCAGG-3', 下游引物序列:5'-GCAGCAGGTTGTCTTGGATGT-3'(64bp, NM_013124)。反应条件如下:95 ℃ 2 min, 和95 ℃ 10 s, 60 ℃ 20 s, 共45个循环。以Δ Δ CT相对定量法计算目的基因mRNA的相对含量[9]。
用SPSS 19.0软件, 采用Q-Q图和Levene检验法检验数据的正态性和方差齐性。两组比较采用t检验, 多组间比较采用单因素方差分析, 同组内两两比较采用LSD(L)法。P< 0.05为差异有统计学意义。
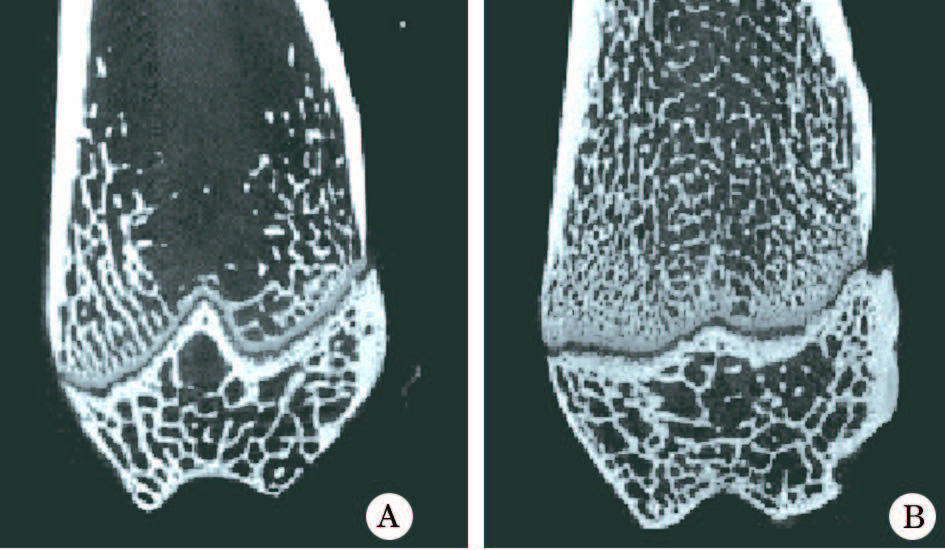
μ CT扫描显示ovx组骨小梁排列较Sham组稀疏, 骨小梁密度减小, 骨量降低(图1)。测定两组骨小梁数量显示, ovx组为(0.747± 0.082)mm, Sham组为(1.791± 0.086)mm, 差异有统计学意义(P< 0.05)。说明双侧卵巢摘除后构建大鼠OP模型成功。
体外分离培养出的BMSC经定向诱导后可以向成骨细胞和脂肪细胞分化(图2)。流式细胞仪检测该细胞高表达间充质细胞表面分子CD90[(98.457± 1.636)%]、CD105[(95.898± 1.575)%], 以及干细胞抗原Sca-1(61.389± 6.115%), 几乎不表达造血干细胞标志物CD34[(1.373± 0.325)%]和CD45[(1.525± 0.484)%]。
在倒置显微镜下连续观察可以发现, EPC原代细胞的形态从初期的长梭形逐渐转变为铺路石状; 荧光显微镜下可见, 原代细胞Dil-acLDL及FITC-UEA-I双重荧光染色结果呈阳性(图3)。
BMSC ovx组细胞增殖能力明显低于BMSC sham组(P< 0.05), 并随着传代次数的增加, 其增殖能力呈逐渐下降趋势。而BMSC ovx/EPC组细胞的增殖能力显著高于BMSC ovx组(P< 0.05, 表1、2)。
| 表1 第3代骨髓间充质干细胞增殖情况的比较( |
| 表2 第6代骨髓间充质干细胞增殖情况的比较( |
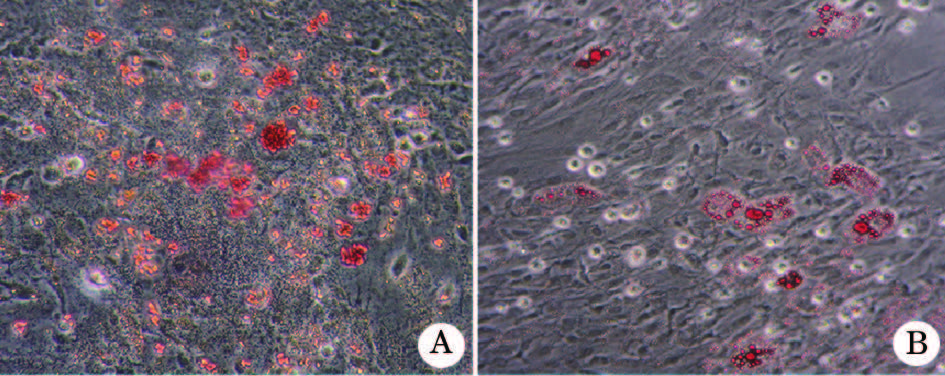
油红O染色显示, BMSC ovx组细胞增殖较慢, 且在细胞集落中出现较多的脂肪细胞。相比之下, BMSC ovx/EPC组中, 其BMSC的细胞数量增加, 脂肪细胞形成的数量明显减少。利用酶联免疫检测仪检测每组的吸光度值(表3), 结果显示, BMSC ovx组脂肪细胞数量显著高于BMSC sham组(P< 0.05), 而BMSC ovx/EPC组明显低于BMSC ovx组(P< 0.05)。另外, PPARγ 2的定量分析结果显示, BMSC ovx组细胞PPARγ 2的表达显著高于BMSC sham组(P< 0.05), 而在BMSC ovx/EPC组中的表达量明显降低(P< 0.05, 表4)。
| 表3 三组BMSC成脂分化油红染色的光密度值比较( |
| 表4 三组骨髓间充质干细胞PPARγ 2 mRNA表达量的比较( |
随着干细胞在OP中的研究日趋成熟, 对OP细胞学病理机制的认知也达到了一个新的高度。早期学者认为, OP 骨形成减少的病理机制是骨髓中BMSC成骨量和成骨功能的下降[2, 10], 因此可以通过增强干细胞的成骨分化能力来治疗OP[11, 12]。随后人们又发现, OP患者骨髓中脂肪细胞增多可能是导致骨髓成骨能力降低的原因, 主要的核心机制可能是BMSC向成骨和成脂细胞分化平衡的紊乱[13]。因此, 通过调节OP中BMSC的成脂、成骨分化的平衡, 抑制成脂促进成骨分化也成为干细胞治疗OP的方法之一[14, 15]。近年来, 通过对OP骨髓中BMSC生物学特性的进一步研究发现, OP不仅仅与BMSC定向分化的平衡紊乱有关, 还与其细胞干性降低或丢失密切相关[16]。在本实验中, 笔者也观察到了BMSC ovx组的细胞增殖速度变慢, 并且随着传代次数的增加, 其增殖速度呈逐渐递减趋势。另外, BMSC ovx组传代至第3代时, 细胞胞质中开始有明显的脂滴形成, 并且随着体外扩增倍数的增加, 脂滴的数量也在增多。以上BMSC ovx组细胞一系列的生物学特性的变化都呈现出OP大鼠BMSC的生长状态不良, 随着传代增加, 将逐渐变为没有增殖能力的终末脂肪分化细胞。据此进一步推测, OP的产生可能与骨髓“ 老化” 、BMSC干性丢失密切相关。因此, 本文将如何提高OP骨髓中BMSC的干性功能, 以抑制其自主脂肪分化作为研究初衷, 以期为OP的干细胞治疗提供新思路。
EPC是一群具有干细胞和内皮细胞的双重特性的祖细胞, 可在早期表达干细胞、晚期表达内皮细胞的相关抗原。然而对于体外如何能够分离培养出真正的EPC尚存在争议[17, 18]。本实验利用连续预接种法从大鼠骨髓中成功获得了EPC。镜下可观察到EPC形态的连续性变化, 细胞从初始的长梭形祖细胞逐渐变成铺路石样的内皮细胞, 并且具备内皮细胞功能。EPC具有形成新生血管的能力, 因此, 在改善局部微循环和微环境方面具有独特优势。本课题组的前期研究结果已证实, EPC通过间接接触可以有效维持BMSC在体外培养时的干性特征[5]。在本实验中, 笔者观察到EPC间接共培养对BMSC ovx组细胞的增殖能力有积极的调控作用。另外, 我们还观察到EPC的间接接触可以明显抑制BMSC ovx组细胞的自主成脂分化。PPARγ 2是目前最具有脂肪细胞特异性的转录因子, 其与配体结合后可直接或间接调节 BMSCs 的成脂分化[19]。本实验中, 笔者检测到PPARγ 2在BMSC ovx组中高表达, 且随着细胞传代次数的增加, 该转录因子的表达呈逐渐递增状态, 而EPC的间接接触可以显著降低PPARγ 2的表达, 并且在多次传代后能够稳定在较低的水平。由此说明, EPC可以正向调控OP大鼠BMSC的增殖能力, 而负向抑制BMSC的自主成脂分化。
EPC与BMSC同源于骨髓, 彼此间相互影响, 构成一个包括细胞及细胞因子或细胞信号的微环境。这种“ 原始” 态的微环境对BMSC的干性调控是比较有优势的。根据以上实验结果, 可以初步揭示EPC的微环境具有调控OP大鼠BMSC干性的潜能, 而抑制其向终末脂肪细胞的自主分化是否是通过调控其干性功能来达到的, 仍需要大量的实验来进行验证。探索一种理想的微环境将OP骨髓中的BMSCs恢复到未分化的状态, 抑制骨髓脂肪化, 可能成为治疗骨质疏松的新思路。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|