作者简介:王 慕,硕士,副主任医师。
目的 探讨负载VEGF、bFGF的聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)纳米微囊复合体对放射性损伤创面愈合的影响。方法 以PLGA为支架联合应用bFGF、VEGF构建纳米微囊,作用于小鼠放射性损伤创面作为实验组,单纯应用PLGA为支架,未用bFGF、VEGF的作为对照组,观察两组创面愈合率、创面的病理改变;于伤后不同时间点检测创面新生血管细胞数目、毛细血管截断面积及成纤维细胞数量;RT-PCR检测创面VEGF mRNA 、bFGF mRNA的表达水平;观察其对放射性创面愈合的影响。结果 实验组创面愈合率明显高于对照组;实验组创面组织中VEGF mRNA、bFGF mRNA的表达均高于对照组,差异均有统计学意义( P<0.05);对创面组织进行HE染色,发现实验组肉芽组织增多增厚,成纤维细胞数量及密度均高于对照组;伤后第8天、第15天,实验组的新生毛细血管数量及毛细血管横截面积均较对照组有所增加,实验组的成纤维细胞计数也明显高于对照组,差异均有统计学意义( P<0.05)。结论 采用负载VEGF、bFGF的PLGA纳米微囊复合体可以促进小鼠放射性损伤创面的愈合。
Objective To study the effects of poly lactic-co-glycolic acid(PLGA) scaffold incorporating VEGF and bFGF loaded nanoparticle complexes on the healing of murine radioactive wounds.Methods Mice undergoing combined application of PLGA and VEGF/bFGF loaded nanoparticle complexes against radioactive wounds were assigned to the experimental group, while those among whom PLGA alone was used to treat radioactive wounds were considered the control group. The wound healing rate and pathological changes of the wounds were observed, while the number of new vascular cells, the area of capillary interception and the number of fibroblasts were detected at different time points after injury between the two groups.Results With regard to the wound surface of mice with radiation injury, the wound healing rate of the experimental group was significantly higher than that of the control group after the combined application of bFGF and VEGF. The expressions of VEGF mRNA and bFGF mRNA in wound tissue of the experimental group were higher than those of the control group, and there was significant difference between the two groups ( P<0.05). HE staining performed on the wound tissue suggested that the granulation tissue in the experimental group increased and thickened, and the number and density of fibroblasts were better than those of the control group. Eight and fifteen days after injury, the number and the cross-sectional area of newborn blood capillaries were both increased in the experimental group compared with the control group, so was the number of fibroblasts.Conclusions PLGA nanoparticle complexes loaded with VEGF and bFGF can promote the healing of radioactive wounds in mice.
放射性物质所导致的慢性创面损伤与普通的损伤不同, 射线可穿透深部组织, 导致创面延迟愈合, 是临床上比较难以处理的问题 [1, 2]。研究表明, 不同的生长因子, 尤其是促进血管再生的细胞分子如血管内皮生长因子(VEGF)、碱性成纤维因子(bFGF)、血小板衍生因子(PDGF)等, 在组织修复、创面愈合过程中发挥重要作用 [3, 4]。但在放射性损伤的创面中, 上述细胞因子表达降低, 进而影响创面愈合。近年来研究发现, 聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid, PLGA)做为特殊的载体支架结合促进创伤愈合的细胞因子(如bFGF或VEGF等)可以促进创伤愈合[5]。本研究旨在探讨负载VEGF、bFGF的PLGA纳米微囊复合体对放射性损伤创面愈合的影响。
取48只体质量(22± 4)g健康雄性4~6周龄的C57BL/6小鼠, 由上海第二军医大学实验动物中心提供。主要实验试剂:PLGA(Purac生物化学公司), Pluronic F-127(Sigma公司), VEGF、bFGF(RD公司), 肝素钠、血清白蛋白(Sigma公司), VEGF、bFGF、GAPDH引物(上海生工生物工程有限公司), SYBR PT-PCR试剂盒(RD公司)。
1.2.1 载有VEGF和bFGF的PLGA纳米微囊复合体(VEGF/bFGF-PLGA)的制备 将25 mg PLGA、25 mg Pluronic F-127溶解在2 ml二氯甲烷中制成有机相。利用300 ng VEGF、300 ng bFGF、4 μ g肝素钠和200 μ g人血清白蛋白加入水中制成200 μ l的水相。有机相与水相涡旋30 s混匀, 形成油包水的乳剂。在磁力搅拌下将这个油包水的乳剂注入到25 ml乙醇中。所得到的悬浮液用25 ml水稀释。将上述液体在30 ℃温度下旋转挥干, 此纳米粒便浓缩在水相介质中。没有载药的纳米粒制备时在水中未加入EGF和bFGF, 余方法同上。采用25 kGy Co60照射灭菌, 低温保存。
1.2.2 实验动物及分组 48只小鼠按6 Gy 60Co-r射线进行一次性全身辐射建立放射性损伤动物模型。小鼠采用全麻后, 在小鼠背部致1 cm× 1 cm全层皮肤缺损伤口, 创面不予缝合, 将无菌没有载药的PLGA覆盖创面小鼠作为对照组(24只), 另外将载有VEGF和bFGF的PLGA纳米微囊复合体(VEGF/bFGF-PLGA)覆盖创面的小鼠作为实验组(24只), 两组小鼠创面均以TegadermTM贴膜包扎伤口, 伤后小鼠自由饮食, 隔日换药, 分笼饲养。
1.2.3 创面愈合率比较 小鼠建立创面后当天采用TegadermTM贴膜覆盖创面, 在透明膜上沿创面边缘描记, 然后用ImageProplusv 1.5分析图像软件, 测量创面面积作为伤口原始面积。 采用同样方法在伤后第4、8、15 天测量伤口残余面积, 创面愈合率(%)=(1-残余面积/原始面积)× 100%。
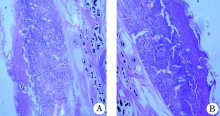
1.2.4 标本取材病理检测 在两组小鼠致伤后第7天以过量麻醉药物致死后取创伤创面组织, 包括伤口周围部分正常皮肤和创面下方的薄层肌肉组织, 采用4%多聚甲醛溶液内固定, 石蜡包埋, 做成组织切片, 常规HE染色, 观察两组创面组织的病理变化。
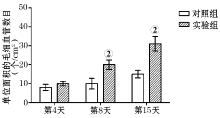
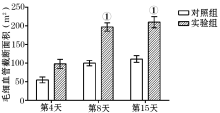
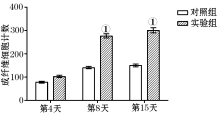
取两组小鼠(每组24只), 分别在致伤后第4、8、15天(每个时间点8只), 处死小鼠后, 取创面组织, 同上述方法做成组织切片, 每张切片在显微镜下(× 40)随机选取10个视野, 计数新生毛细血管、成纤维细胞数目, 计算毛细血管截断面积, 分别取其平均值。
1.2.5 Realtime PCR检测创面组织中VEGF、bFGF mRNA表达 在上述实验组和对照组小鼠致伤2周后, 每组取8只, 分别取局部创面组织, 按试剂盒说明步骤提取总RNA, 紫外分光光度仪测A260/A280值, 并计算RNA浓度。反转录获得cDNA文库, 采用SYBR PT-PCR试剂盒和StepOneTM实时定量PCR定量检测系统进行测试。以标本内GAPDH mRNA作为细胞内mRNA表达的基准, 1代表对照组标本内目的基因表达水平, 依照2-Δ Δ Ct方法进行评估, 对实验组标本内测试基因表达水平进行标准化比对。所有检测均进行3次独立的重复操作。
采用SPSS 16.0统计软件进行分析, 计量资料采用
伤后第4天, 两组之间创面愈合率比较无统计学差异; 实验组伤后第8天及第15天创面愈合率高于对照组, 差异有统计学意义(P< 0.05, 表1)
| 表1 两组小鼠放射性创伤后不同时间点创面愈合率比较(%; |
创伤后第15天实验组创面组织中VEGF mRNA、bFGF mRNA分别为12.4± 0.8和4.0± 0.2, 高于对照组相应的2.3± 0.5和1.0± 0.1, 差异有统计学意义(P< 0.05)。
创伤后第7天, 对照组创面肉芽组织层偏薄, 新生的毛细血管较少, 成纤维细胞少; 实验组肉芽组织增多增厚, 成纤维细胞数量及密度均高于对照组(图1)。
伤后第4天, 实验组创面新生毛细血管计数及毛细血管横截面积与对照组比较, 差异无统计学意义; 在伤后第8天、第15天时, 实验组的新生毛细血管数量及毛细血管横截面积均较对照组有所增加, 差异均有统计学意义(P< 0.05, 图2、3)。
在现代战争及未来可能发生的核战争中, 放射性创伤是导致创伤难以愈合, 甚至致死的主要原因之一。研究表明, 放射性损伤与普通创伤相比较, 其创伤创面早期炎性反应削弱、成纤维细胞和上皮细胞增殖减少; 后期肉芽组织及胶原基质产生减少, 故而组织上皮化速度减慢, 导致愈合困难 [6]。同时放射性创伤所导致的组织损伤, 局部组织损伤严重, 细胞生存环境变化大。尤其是当这一类患者或伤员在合并全层皮肤组织创伤及深层组织损伤时, 其伤口的愈合就更加困难, 甚至形成难愈性创面, 给患者的生活和经济带来很大的负担。
创伤的组织修复及愈合过程比较复杂, 其中包含着诸多如细胞的分裂及迁移、合成新的基质、新生的血管形成、新生的上皮细胞等细胞参与的活动[7, 8]。近年来的研究表明, 在创面修复过程中, 有许多细胞生长因子参与了调控血管生成、上皮再生化及肉芽组织的生成; 在放射性损伤创面愈合过程中, 不同生长因子在创伤愈合的不同阶段也发挥着更为重要的作用[9, 10]。但既往的研究发现, 细胞生长因子在创面促愈的过程中均存在着半衰期短、作用时间不足的问题; 同时创面中所包含的间充质细胞及炎性细胞也通过其释放到创面组织中的酶, 降解发挥促进愈合的细胞因子, 使其促进愈合作用大大削弱, 因而这些不利于创面愈合的因素均需要特定的保护剂和良好的载体系统, 并使促进愈合的细胞因子在创面长时间保持一定的有效浓度, 才能稳定发挥促进愈合的作用[11, 12, 13]。近年来, 有研究发现, 利用PLGA微球作为新型的载体混合生长因子制成复合缓释剂, 不仅具有无毒、可生物降解和生物相容性好等特征, 而且其降解的时间可受其构成物的分子量和聚合物含量比例的调节, 很大程度上保持了生长因子的活性和持续释放, 真正达到了加速创面的愈合、提高愈合质量的目的[14, 15, 16]。
慢性放射性损伤创面的修复过程比较复杂, 创面新生肉芽组织中内皮细胞生长及增生会直接影响创面的愈合。肉芽组织主要由新生毛细血管及成纤维细胞组成, 而促进血管生成及成纤维细胞生成的细胞因子, 就可以加速创面愈合[17]。其中VGEF特异性地与血管内皮细胞作用, 并可使血管的通透性增加, 血浆蛋白渗出到血管周围的间隙中, 渗漏到血管周围的纤维蛋白原会转化成纤维蛋白, 促进血管形成并不断扩大生长[18]。而bFGF做为一组多肽, 生物学活性比较广泛, 可作用于血管内皮细胞, 促进其有丝分裂, 诱导血管内皮细胞分泌某些蛋白酶, 溶解并侵入周围基质, 进而形成毛细血管; 同时促进内皮细胞及成纤维细胞向创面迁移, 加速创面的愈合[19]。
本实验通过构建小鼠的放射性损伤模型, 以PLGA为支架, 联合应用bFGF、VEGF, 观察VEGF/bFGF-PLGA在放射性损伤创面愈合中的作用及可能机制。研究发现, 在放射性损伤小鼠背部创面应用VEGF/bFGF-PLGA 后第15天, 创面组织中VEGF、bFGF mRNA的表达明显升高, 同时治疗组在伤后第8天及第15天, 创面愈合率明显高于对照组, 提示在放射性损伤创面应用VEGF/bFGF-PLGA后, 创面可以持续地高表达bFGF和VEGF, 使bFGF、VEGF分子持续作用于创面, 达到促进创面愈合的有效浓度, 进而促进创面的愈合。
本实验病理分析发现, 应用VEGF/bFGF-PLGA第8天及第15天, 实验组的新生毛细血管数量及毛细血管横截面积均较对照组有所增加, 差异有统计学意义; 同时实验组的成纤维细胞计数也明显高于对照组(P< 0.05)。说明VEGF/bFGF-PLGA促进创伤愈合的机制可能在于其使放射性损伤创面的肉芽组织中bFGF、VEGF的 mRNA表达升高, 使bFGF、VEGF发挥共同的作用, 并使bFGF、VEGF在创面上持续有效地表达, 促进了创面新生血管的生成及成纤维细胞的增殖, 改善了创面的血液循环, 从而使创面愈合速度加快, 促使放射性损伤创面愈合。
总之, 本实验的研究为丰富难愈伤口的理论提供了一定的实验基础, 并为治疗放射性损伤创面提供了新的思路, 为平时及战时放射性损伤的救治提供了新的方法, 下一步将开展更深入的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|