作者简介:韩文娟,本科学历,主治医师。
急性主动脉综合征(acute aortic syndrome, AAS)是1998年由Vilacosta和Romá n [1]首次提出, 是一组累及胸腹主动脉的具有相似临床表现并不断进展、具有潜在严重后果的疾病。该病包括主动脉夹层(aortic dissection, AD)、主动脉壁内血肿(intramural aortic hematoma, IMH)、穿通性主动脉溃疡(penetrating aortic ulcer, PAU)、创伤性主动脉撕裂(traumatic aortic lacerations)和不稳定的胸主动脉瘤(thoracic aortic aneurysm, TAA)[2, 3, 4]。以上几种病变可以共同存在、互相演变, 其中以主动脉夹层为最常见类型, 主动脉壁内血肿和穿透性主动脉溃疡均可以演变成典型的主动脉夹层, 故又被称为不典型主动脉夹层[5]。AAS通常起病急、且病死率高, 临床难以鉴别。多排螺旋CT(multi-detector computed tomography, MDCT)具有快速、无创、高敏感性和特异性的特点, 已成为AAS急诊应用中极其重要的检查手段, 可以为临床诊断、治疗方案选择提供客观依据。本文旨在分析经CT及临床确诊的AAS患者MDCT三维重建影像特征及病变分布。
回顾性分析武警总医院2015-01至2017-12以急性胸痛入院的患者, 均行64层MDCT增强扫描和血管三维成像, 经CT及临床确诊的AAS患者136例。其中男102例, 女34例, 年龄25~85岁, 平均54岁。其中AD82例, IMH31例, PAU23例。102例有高血压病史, 48例有糖尿病史, 均有急性胸背部疼痛, 部分患者同时出现胸闷、气短、腹痛、呕吐等症状。
采用GE/Discovery CT 750HD扫描, 管电压120 kV, 动态管电流范围150~650 mA, 螺距0.984:1, 层厚5 mm, 1.25 mm层厚重建。扫描范围从胸廓入口处至双侧髂内、外动脉, 将升主动脉设为感兴趣区, 采用智能追踪扫描技术, 于肘静脉处以4 ml/s的速率注入碘佛醇80 ml, 之后以相同速率注入40 ml生理盐水, 进行扫描。
扫描完成后, 将图像传至GE AW4.5工作站上进行三维重建, 包括容积再现(VR)、多平面重组(MPR)、最大密度投影(MIP)、曲面重组(CPR), 由两位高年资医师进行图像分析。
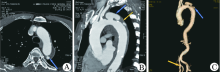
1.4.1 AD 男67例, 女15例。根据Debackey分型, Debackey Ⅰ 型13例, Debackey Ⅱ 型3例, Debackey Ⅲ 型66例, 其中1例继发于马方综合征(Marfan, s syndrome), 1例发生于妊娠期。均见到主动脉呈双腔征象及低密度的撕裂内膜片, 42例钙化内膜片向腔内移位, 夹层分别累及头臂动脉6例, 左颈总动脉4例, 左锁骨下动脉1例, 腹腔动脉12例, 肠系膜上动脉5例, 右肾动脉6例, 左肾动脉7例, 髂动脉28例, 1例累及右冠窦。同时发现心包积液6例, 胸腔积液28例。并发左肾缺血2例。图1示主动脉夹层Ⅲ 型1例。
 | 图1 主动脉夹层Ⅲ 型MDCT三维重建影像 A.主动脉撕裂内膜片(箭头所示); B. MPR显示胸-腹主动脉双腔形成(箭头所示), 右肾动脉起自真腔, 左肾动脉起自假腔; C.VR重建可直观显示主动脉及双腔范围 |
1.4.2 IMH 男21例, 女10例。根据Debackey分型, Debackey Ⅰ 型7例, Debackey Ⅱ 型5例, Debackey Ⅲ 型19例, CT表现为主动脉壁增厚, 厚度> 5 mm, 呈环形或半月形, 呈中等密度, 增强扫描后无强化。
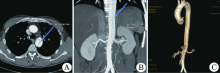
1.4.3 PAU 男14例, 女9例。其中6例合并主动脉壁内血肿, 1例形成假性动脉瘤。图2示穿通性溃疡合并主动脉壁内血肿1例。
AAS是起病急、病情进展迅速, 具有相似临床表现的综合征, 又被称主动脉性疼痛[6]。AD是最为常见的AAS分型, 可由各种病因导致主动脉内膜破裂或中膜弹力纤维层病变, 血液从主动脉内膜撕裂处进入中膜, 导致中膜分离并沿主动脉长轴扩展, 从而造成主动脉形成真、假两腔的一种病理改变。AD急性期可以导致主动脉破裂、脏器缺血、梗塞, 慢性期可形成夹层动脉瘤。根据病变范围及破口位置, 分为三型(Debackey分型)。MDCT表现为主动脉管腔扩张, 主动脉壁局部破损即为破口, 内膜撕裂呈线样低密度影, 分隔为真假腔, 通常真腔小, 强化同主动脉一致, 假腔大, 呈“ 鸟嘴状” 或“ 蜘蛛网状” 。受血流速度影响, 真腔密度通常较假腔密度高, 真腔显影及排空较假腔快[7]。MPR可以直观地从不同层面、角度展示破口位置、内膜片的形态, 真腔及假腔的鉴别, 受累分支受累情况及与周围结构的关系。VR对腔内结构的观察不如MPR, 但可以立体直观地显示夹层的范围及与周围结构的关系, 对于指导临床手术有重要意义。
IMH是由于主动脉壁滋养血管破裂和主动脉壁溃疡导致中膜弹力纤维破坏, 血液进入主动脉中层形成血肿。CT表现为主动脉壁增厚, 呈半月状或环状, 增强扫描后血肿无强化。MDCT可以清楚显示壁内血肿的位置、范围, 对于治疗后随访观察主动脉恢复情况、预后评估等有重要意义。
PAU主要发病原因是主动脉壁粥样硬化斑块破裂, 穿透内膜或内弹力板, 侵及中膜, 脱落后呈溃疡样改变。病变位置通常位于外膜下, 常伴周围血肿, 多见于老年男性, 多伴高血压, 约90%发生于降主动脉。CT呈壁在性“ 充盈缺损” 及深大的“ 龛影” , 可合并局限性血肿, 纵隔、胸腔或心包血性积液。MPR可以清晰显示溃疡的位置、范围及有无穿通, 为主动脉溃疡转归、预后的随访提供重要意义。
目前临床上对AAS的影像学检查方法, 通常有超声、MDCT、MRI及主动脉造影检查。超声作为常用的心血管疾病影像检查方法, 虽然可以了解血流动力学情况, 但是由于存在检查范围受限, 同时受气体及骨骼的影响等因素, 不能作为主动脉病变的首选检查方法; MRI虽然对病变能够准确清晰的显示, 但同时具有扫描时间长患者不能很好配合的缺点, 而进行该项检查的通常都是一些临床症状比较急且病情危重的患者, 同时MRI对血管壁的钙化显示欠佳[8]; 主动脉造影为创伤性检查, 对于AAS患者的检查具有一定的危险性; MDCT具有快捷、无创、扫描范围广的优点, 因此对AAS的诊断具有重要价值。
CT横断面图像能够清晰显示撕裂的内膜片、真假腔的鉴别、破口位置、钙化、附壁血栓等重要征象, 同时显示间接征象如心包积液、胸腔积液等, 但对于病变的全貌及与重要分支血管的关系有时显示欠佳, 因此需要结合三维重建技术, 两者互补, 可以准确、直观地确定病变部位及范围。MPR可以从多角度观察病变情况, 对于内膜破口位置、附壁血栓等病变细节能够清晰显示; CPR对于真假腔显示及与周围重要分支血管的关系、撕裂内膜片显示较好; VR、MIP且能从多角度立体直观的观察病变, 同时显示真假腔与分支血管的关系等。对于部分AAS病变, 仅靠一种CT重建方式无法满足诊断需求, 因此在横断面图像基础之上, 结合多种三维重建方式, 全面显示病变部位及与邻近结构的解剖及空间关系, 能够极大地提高对该疾病的诊断, 可对临床制定治疗方案及评估预后提供重要的依据, 因此MDCT联合三维重建技术应当作为AAS检查的首选方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|