目的 探讨银杏叶提取物对氯吡格雷人体内药动学影响及其相关机制。方法 选取14名健康男性志愿者,第一阶段服用氯吡格雷150 mg/d(单用药组);第二阶段进洗脱期后,受试者连续服用银杏叶提取物240 mg/d,连续14 d,第14天给予银杏叶提取物1 h后,再空腹服用氯吡格雷(联用药组)。两组均在给药后采集受试者0~24 h外周静脉血,检测氯吡格雷代谢产物SR-26334的浓度。此外,建立体外Caco-2细胞模型,以罗丹明-123和维拉帕米分别为阴性和阳性对照,采用流式细胞技术检测银杏叶提取物和氯吡格雷对Caco-2细胞内的荧光强度的影响。结果 联合用药组受试者血中SR26334的AUC(0-t)(3192.3±45.035)[(mg·h)/L]、AUC(0-∞)(3343.017±43.829)[(mg·h)/L]和Cmax(340.988±11.257)[(mg·h)/L]均高于单独用药组,CL/F(0.071±0.007)低于单独用药组( P<0.05)。Caco-2细胞内荧光强度,银杏叶提取物组(487±14.12)和联合用药组(497±17.22)高于阴性对照组( P<0.05)。结论 银杏叶提取物能显著提高氯吡格雷羧酸在人体内的生物利用度和吸收总量,其作用机制可能与银杏叶对P-糖蛋白(P-gp)的抑制作用有关。
Objective To study the effects of Ginkgo biloba extract on pharmacokinetics of clopidogrel and its mechanism.Methods Fourteen healthy male volunteers took a single 100-mg oral dose of clopidogrel either alone or after pretreatment with 240 mg Ginkgo biloba extract daily for 14 days. On day 14, a single 100-mg oral dose of clopidogrel was administered. Plasma SR26334 concentrations of clopidogrel from zero to 24 h were measured by high-performance liquid chromatography.Results AUC(0-t)(3192.3±45.035), AUC(0-∞)(3343.017±43.829) and Cmax(340.988±11.257) of SR26334 in the combination group was significantly higher than that of the single-drug group ( P<0.05).Conclusions Ginkgo biloba extractcan increase the bioavailability and absorption of clopidogrel. The mechanism may be related to Ginkgo biloba’s significant inhibition of P-glycoprotein.
银杏叶主要含黄酮类、酚酸类等化合物, 其药理作用为抗氧化、清除自由基、增加血流量及神经保护等[1, 2, 3]。氯吡格雷是腺苷二磷酸受体的一种抑制药, 能抑制血小板的相互聚集[4], 是临床常用抗血小板聚集药物之一。然而, 氯吡格雷是仅有15%在肝脏CYP450 酶作用下转化为活性代谢产物, 而其余转化为非活性代谢产物氯吡格(SR-26334), 发挥药理作用[5]。实验室以大鼠为研究对象, 发现银杏叶片对氯吡格雷的生物利用度和吸收总量具有显著的增强作用, 两药合用对心脏功能有显著的改善作用[6, 7]。P-糖蛋白(P-glycoprotein, P-gp)在药物的吸收、分布和排泄等过程中发挥着重要作用。研究表明, 药物可通过抑制P-gp功能影响药物吸收或利用度等[8]。因此, 本研究建立体外Caco-2 细胞模型, 经过具有荧光性质的P-gp底物罗丹明-123(Rhodamine 123, Rho-123 )和各药物单独或联合处理, 测定各组荧光强度变化, 评价各药对P-gp功能的影响, 从而对其相关机制研究。
选取14名男性健康受试者, 年龄20~23岁, 体重60~63 kg; 入选标准:(1)无药物过敏史、药物依赖史、慢病史, 无烟、酒嗜好; (2)血压、脉搏等生命体征检查均正常, 心电图检查及血、尿常规和肝、肾功能等检查均在正常值范围; (3)近两周内, 未服用过影响本研究吸收、代谢的药物; (4)均签署知情同意书。试验期间受试者统一清淡饮食, 并聘请一名具有GCP结业证书的主治医师与2名具有多年工作经验的护士进行实时观察药物的不良反应。本研究经医院伦理委员会通过。
1.2.1 试剂与仪器 银杏叶片(购于江苏康缘药业股份有限公司, 批号:160804), 硫酸氢氯吡格雷(购于赛诺菲制药有限公司, 批号:20160104); SR26334 标准对照品(由深圳信立泰制药有限公司提供, 纯度为99.2%)。维拉帕米盐酸盐、Rho-123、二甲基亚砜均购于sigma。Mettler电子天平、台式冷冻离心机、涡旋混合器、岛津LC-20A(配置自动进样系统和二极管阵列检测器; 岛津, 日本)、XW-80A型微型涡旋混合仪(上海舜宇恒平科学仪器有限公司)。Millipore流式细胞仪(北京维欣仪奥科技发展有限公司)。Caco-2细胞株, 由中国科学院上海细胞库提供。
1.2.2 实验方案 受试者在第1阶段单独服用氯吡格雷150 mg/d(75 mg/片), 之后经过14 d洗脱期; 第2段连续服用银杏叶片240 mg/ d(60 mg/粒胶囊)14 d, 第14天服用银杏叶片1 h后, 所有受试者空腹服用氯吡格雷; 分别在第1阶段和第2阶段服用氯吡格雷后采集受试者0、0.5、1、2、3、4、5、6、8、10、12、24 h外周静脉血, 分离血浆待测。服药后受试者均在观察室内休息, 避免剧烈运动和长时间卧床等影响受试者安全与健康的行为。
1.2.3 色谱条件 色谱柱:Zorbax SB-C18(2.1 mm× 50 mm, 3.5 μ m); 流动相为乙腈:水:0.1% TFA=24:56:20(体积比); 检测波长为230 nm和280 nm; 流速为1.0 ml/min; 柱温:40 ℃, 进样量:10 μ l。
1.2.4 样品预处理方法 采集不同时间段的血液于肝素抗凝管中, 离心10 min, 取上清, -20 ℃保存, 待测。精密吸取待测血浆样品200 ml, 3000 r/min离心5 min, 取100 ml上清, 加10 μ l的莫西沙星内标工作液(浓度为400 mg/L), 再加入10 μ l的70%高氯酸, 涡旋混匀, 13 000 r/min离心5 min, 取上清, 进液相检测。另同法制备空白血浆和空白血浆+ SR26334标准品+莫西沙星内标样品, 进液相检测, 计算不同时间受试者血药浓度。
1.2.5 血浆标准曲线制备 向空白血浆中, 加入不同浓度的SR26334 标准工作溶液, 配制成浓度相当于0.5、1、2.5、5、10、25、50 μ g/ml的血浆样品, 并按上述血浆样品处理方式进行处理之后进液相检测, 绘制标准曲线。
1.2.6 精密度、回收率及稳定性实验 (1)精密度考察:制备SR26334浓度为20、1000、4000 μ g/ml标准品血浆溶液, 处理方法同“ 2.3” 项下, 同一天内不同时间处理样品并测定5次, 考察日内精密度。处理方法同日内, 连续5 d, 每天同一时间测定1次, 考察日间精密度。(2)回收率考察:制备SR26334血浆标准品溶液浓度为20、1000、4000 μ g/ml, 处理方法同“ 2.3” 项下, 按照“ 2.4” 项下所得标准曲线求得的SR26334浓度与加入的已知浓度相比, 计算相对回收率。另用甲醇配制上述浓度对照品, 不经血浆样品处理直接进样计算SR26334与内标峰面积之比为标准, 与经过血浆样品处理所得样品峰与内标峰面积比作比较, 得绝对回收率。(3)稳定性实验:制备SR26334血浆标准品溶液浓度为20、1000、4000 μ g/ml, 处理方法同“ 2.3” 项下。分别在室温放置24 h、冻-融3次、长期冻存7 d, 测定RSD。
1.2.7 银杏叶提取物和氯吡格雷对P-gp功能的影响 参考文献[9]方法, 培养细胞并建立Caco-2细胞模型。用0.25%的胰蛋白酶处理对数生长期的Caco-2, 离心, 用PBS制备细胞悬液, 并将细胞密度调整为1× 106 count/ml。取0.5 ml细胞悬液, 离心, 去掉上清, 再通过不同的药物(表1)进行处理后, 于37 ℃、含5%的CO2的培养箱中孵育1 h, 之后冰上终止处理。于4 ℃, 1000 r/min, 离心5 min, 弃上清, 用冰PBS洗涤两次, 加入2 μ g/ml Rho-123或PBS, 于37 ℃、含5%的CO2的培养箱中, 孵育1 h后, 冰上终止转运。4 ℃, 1000 r/min, 离心5 min, 弃上清, 加冰PBS洗涤2次, 加PBS重悬。通过流式细胞仪检测细胞检测Rho-123荧光强度。激发波长和发射波长分别为488 nm和535 nm, 各组荧光强度用其对照荧光强度校正, 每个浓度分别重复3次。
| 表1 银杏叶提取物对氯吡格雷人体内药动学实验的分组与给药情况 |
药-时曲线数据用Drug And Statistics of Windows 2.0(DAS 2.0)软件处理; 采用SPSS 20.0软件统计处理数据, 采用t检验, P< 0.05为差异有统计学意义。
在给定的色谱环境下, 空白血浆、标准加样血浆和联合用药2 h 的血浆样品色谱见图1。在本研究条件下, 氯吡格雷酸及内标非那西汀色谱分离良好, 内标保留时间为5.6 min, 氯吡格雷酸保留时间为9.2 min(图1)。
根据血浆标准曲线所测结果, 得回归方程为:Y= 0.512X+ 0.0314(R2 =0.9996)。结果表明, 血浆中氯吡格雷酸在0.5~50 μ g/ml 浓度范围内具有较好的线性关系。
日内精密度为4.25%, 日间精密度4.33, 均小于6%。相对回收率(98.22%)在89.66%~101.77%, 绝对回收率(97.23%)88.34%~98.88%。样品室温放置24 h、冻-融循环3 次和长期冻存14 d测定RSD分别为8.55%、8.48%、8.89%, 均小于15%, 提示氯吡格雷酸在血浆中稳定, 即满足测定要求。
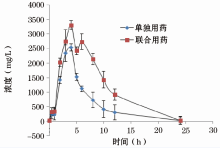
2.4.1 药时曲线 给药后分别于0.09, 0.5, 1, 2, 3, 4, 5, 6, 8, 10, 12, 24 h取血处理, 用HPLC 法测得不同时间的SR26334血浆药物浓度, 绘制药时曲线。两组SR26334 平均血药浓度-时间曲线比较, 结果表明联合用药组SR26334的血浆峰值和曲线下面积高于单独用药组, 即单独用药组清除率快于联合用药组(图2)。
2.4.2 药动学参数 通过DAS软件处理SR26334的血浆浓度, 用非房室模型估算药动学参数:血浆药物峰值浓度(Cmax)、达峰时间(Tmax)、半衰期(T1/2)、清除率(CL/F); 两组的AUC(0-t)、AUC(0-∞ )、Cmax经对数化处理, T1/2和CL/F采用DAS统计数据。结果表明与单独用药组相比, 联合用药组中SR26334的AUC(0-t)、AUC(0-∞ )和Cmax值均显著降低(P< 0.05, 表2), 而CL/F显著升高(P< 0.05), Tmax、t1/2z差异无统计学意义。
| 表2 氯吡格雷酸的主要药动学参数(n=14; |
与罗丹明组相比, 不同浓度的氯吡格雷组荧光强度均无统计学意义, 而不同浓度的银杏叶提取物组中, 高剂量银杏叶提取物组荧光强度显著升高(P< 0.05, 表3)。同时结果发现高剂量的银杏叶提取物和高剂量氯吡格雷联合用药即联合用药组荧光强度显著升高(P< 0.05)。
| 表3 各组细胞荧光强度检测结果(n=3; |
银杏叶是临床常用的中草药, 主要含黄酮类、酚酸类等化合物, 其药理作用为抗氧化、清除自由基、增加血流量及神经保护等[1]。氯吡格雷常常联合用药, 有研究通过对氯吡格雷联合阿托伐他汀钙用于TIA患者发现, 联合用药效果明显优于单用氯吡格雷[7, 8, 9, 10]; 文献[11]通过观察氯吡格雷联合阿司匹林治疗稳定型心绞痛伴糖尿病的临床的疗效, 发现联合用药具有更好的疗效。目前研究表明氯吡格雷与银杏叶片两药合用具有较好的疗效, 如对心脏功能具有显著的作用[6]; 同时研究发现联合用药影响其生物利用, 如长期用银杏叶提取物对氯吡格雷生物利用度和吸收总量有一定影响[7]。然而目前对于人体内两者代谢相互作用未见研究报道。研究表明氯吡格雷在肝脏CYP450 酶作用下仅有15%左右转化为活性代谢产物, 而其余转化为非活性代谢产物SR-26334, 发挥药理作用[5]。从而得出SR26334是氯吡格雷的主要代谢物, 故通过检测SR26334浓度观察氯吡格雷机内的代谢变化。本研究通过银杏叶提取物对人体内氯吡格雷药动学影响, 将实验分为两个阶段, 单独服用氯吡格雷和连续服用银杏叶提取物后继而服用氯吡格雷, 对比服用银杏叶提取物前后体内血中SR26334相关药代参数, 以期为临床银杏叶提取物和氯吡格雷的联合用药提供理论依据。本文实验结果表明, 长期服用银杏叶片有助于提高氯吡格雷在人体内的利用度和吸收总量。
药物代谢主要肝脏中进行, 在此过程中CYP450起着至关重要的作用, 其中最重要的是CYP3A亚族。然而研究表明CYP3A酶系与P-gp具有相同的组织分布和底物。P-糖蛋白(P-gp)是一种转运药物分子进出细胞的外排蛋白, 在动物体内广泛存在, 在器官和正常组织如肾脏、肝脏及肠道等中有着丰富的表达[12]。研究表明银杏叶片中槲皮素、山奈酚等黄酮类化合物对P-gp功能具有抑制作用, 它也可通过与外排转运体和代谢酶的相互作用而影响底物的吸收[13, 14]。在体内, 银杏叶片和氯吡格雷均为P-gp的底物, 并且影响氯吡格雷在十二指肠吸收的主要因素也是P-gp。因此我们进一步进行体外实验, 以期研究相关机制。目前人结肠腺癌细胞(Caco-2)常用于药物转运机制研究[15]。本研究通过建立体外模型, 研究银杏叶提取物和氯吡格雷对P-gp的作用, 结果表明氯吡格雷组荧光强度无显著变化, 而银杏叶提取物组和联合用药组荧光强度显著升高, 即表明单用氯吡格雷时对P-gp无显著抑制作用, 而单用银杏叶提取物或联合氯吡格雷用药呈现明显的抑制作用, 该结果提示银杏叶提取物对P-gp有较强的抑制作用。结合我们前期药动学实验结果, 可以推测长期服用银杏叶片能增加氯吡格雷在人体内的吸收总量, 氯吡格雷在人体内吸收总量的增加可能与银杏叶片对P-gp的抑制有关。
综上所述, 本文研究银杏叶提取物对人体内氯吡格雷药动学影响, 结果表明相关机制可能是银杏叶提取物抑制P-gp的功能导致, 这对临床用药具有一定的指导意义。但本研究还存在一定的局限性, 对相关机制研究仅局限于体外细胞模型, 发现银杏叶片对P-gp抑制的作用, 并未阐明其是否在人体内具有抑制作用, 有待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|