目的 通过比较小鼠肾小球分离技术,明确小鼠原代足细胞培养的最优方法。方法 分别采用差异过筛法和免疫磁珠法分离C57/BL6J小鼠肾小球,用Ⅳ型胶原酶消化去除包曼囊,用相差显微镜观察肾小球纯度和形态结构,采用免疫荧光染色和聚合酶链反应法(polymerase chain reaction,PCR)鉴定足细胞的标志蛋白Podocin的分布和表达。结果 差异过筛法获得肾小球纯度达90.2%±1.6%,一只C57/BL6J小鼠可以得到(10 421±2421)个肾小球;视野中肾小球结构完整,可见肾小管碎片。免疫磁珠法获得的肾小球纯度达96.7%±1.2%,一只C57/BL6J小鼠可以得到(16 112±2651)个肾小球;视野中肾小球结构完整,基本无肾小管。免疫磁珠法获得肾小球纯度和数目均高于差异过筛法,差异均有统计学意义( P<0.05)。7~10 d可见肾小球周围大量多边形细胞爬出,呈铺路石样外观,符合足细胞特征;免疫荧光染色和PCR法均证实有足细胞特异性蛋白Podocin表达。结论 C57/BL6J小鼠肾小球的分离,免疫磁珠法明显优于差异过筛法,可以更简便、高效地培养出原代足细胞。
Objective To find the optimal method of culturing primary podocytes in mice by comparing different glomerular separation techniques.Methods The renal glomeruli of C57/BL6J mice were obtained by sieving and with Dynabeads,while Bowman’s capsules were removed by digesting the glomeruli in type IV collagenase. Furthermore,the inverted phase contrast microscope was used to observe the structure of isolated renal glomeruli,expressions of podocin,while DAPI was observed by double-labeling immunofluorencence. Finally,the levels of podocin mRNA were measured by PCR.Results By using the conventional sieving method, the number of glomeruli isolated from one C57/BL6J mouse was 10 421±2421 with a purity of 90.2%±1.6%.The glomerular structure was complete and renal tubule fragments could be seen. However, with the Dynabeads method,the number of glomeruli isolated from one C57/BL6J mouse was 16112±2651 with a purity of 96.7%±1.2%,the glomerular structure was complete and there were few renal tubules. The purity and number of glomeruli obtained with Dynabeads were higher or larger than those obtained with the differential screening method,and the difference was statistically significant.A larger number of cobblestone-like cells that outgrew around nearly each glomerulus from the 7th to 10th day were observed with immunofluorescent staining, which was the characteristic of podocytes. The PCR results showed that the podocytes expressed podocin.Conclusions The test result has offered more proof that Dynabeads method is superior to the differential sieving method in isolating glomeruli from C57/BL6J mice because it is simple and highly effective for culturing primary glomerular podocytes.
足细胞在蛋白尿的发生发展中起重要作用[1], 但因其为高度分化的终末期细胞, 其体外培养一直较为困难。国外已有实验室成功建立人、鼠条件永生化足细胞株[2, 3], 但细胞株在生长、遗传特征及细胞结构等方面与原代细胞相差较大, 不能很好地模拟相关的肾脏病理生理学状况, 这使基于永生化足细胞株的实验结果的可信度大大降低。以前的文献主要集中在大鼠的原代足细胞培养, 有关小鼠足细胞原代培养技术少见报道。本研究通过比较差异过筛法和免疫磁珠法, 旨在明确小鼠肾脏足细胞原代培养的最佳模式。
C57/BL6J小鼠, 30 g, 由上海斯莱克实验动物有限公司提供。激光共聚焦显微镜购自Leica SP8公司, 相差显微镜购自OLYMPUS公司, 免疫磁珠购自Dynal公司, PCR 仪购自ABI公司。RPMI 1640培养液购自Cornning公司, Ⅳ 型胶原酶、链酶蛋白酶E、脱氧核糖核酸酶Ⅰ 均购自Sigma公司, 胎牛血清购自Gibco公司, Podocin抗体购自Abcam公司, 荧光二抗购自Cell Signaling Technology公司, 逆转录试剂盒及Trizol购自Invitrogen公司, 曲拉通 X-100及80、150、300目不锈钢筛网购自上海生工技术有限公司。
1.2.1 差异过筛法 小鼠腹腔注射2.5% 戊巴比妥(0.1 ml/30 g), 麻醉后, 用75% 乙醇消毒皮肤, 先后暴露腹腔、胸腔, 行心脏灌注后迅速取出双侧肾脏, 置于4 ℃ D-Hank’ s 溶液中。去除包膜, 分离肾皮质, 用眼科剪将皮质剪成碎泥状。用注射器针芯轻轻研磨肾皮质, 并不断用D-Hank’ s 溶液冲洗。该冲洗液先过80 目不锈钢筛网, 滤过的溶液再过150 目的不锈钢筛网, 最后过300 目筛网。滞留在300 目筛网上即为肾小球初分离物, 反复冲洗筛网后, 收集分离物制成悬液, 静置10 min 后, 1000 r/min离心5 min, 弃除上清, 收集纯化的肾小球沉淀, 加入含10%胎牛血清的RPMI 1640培养液制成肾小球悬液。
1.2.2 免疫磁珠法 常规动物麻醉、消毒皮肤, 采用Liu等[4]方法从胸主动脉灌注, 在肾脏建立局部循环。从胸主动脉先用37 ℃预热的PBS灌注10 ml(5 ml/min), 然后灌注37 ℃预热的总体积4 ml, 包含有(胶原酶10 mg/ml+链酶蛋白酶E 10 mg/ml+脱氧核糖核酸Ⅰ 100 U/μ l+免疫磁珠 200 μ l)液体, 灌注结束后迅速取出动物双侧肾脏, 置于4 ℃ D-Hank’ s 溶液中。去除包膜, 分离肾皮质, 用眼科剪将皮质剪成碎泥状。移入2 ml离心管, 再加入上述消化酶1 ml, 震荡孵育37 ℃, 300 r/min, 5 min。用移液枪轻柔吹打数次, 过150目金属筛1次, 借助磁力架洗涤、重悬, 转入离心管中1000 r/min 离心5 min, 弃上清, 加入含10%胎牛血清的RPMI 1640培养液制成肾小球悬液。
用10%胎牛血清的RPMI 1640培养液悬浮肾小球, 倒置相差显微镜下观察其形态。经血球计数板计数不同分离方法得到的每只C57/BL6J小鼠的肾小球数目, 同时计算无鲍曼囊肾小球占总肾小球的百分比, 即为肾小球纯度。以2× 104/孔的密度接种于六孔板中, 置于37 ℃、5% CO2培养箱内继续培养。
传代培养7 d, 待细胞分化铺满瓶底后再行免疫荧光染色。步骤:足细胞以适当密度种植于24孔板上, 37 ℃培养至细胞密度为60%~75%。4%多聚甲醛固定15 min, 0.5%曲拉通 X-100穿孔15 min, 1%牛血清白蛋白封闭30 min, 分别加一抗Podocin(1:1000)4 ℃过夜, 然后加1:500稀释的二抗室温反应1 h, 然后加DAPI(1:1000)3 min, 上述每步操作后均用PBS漂洗。荧光显微镜下观察。
以永生化小鼠足细胞为阳性对照, 小鼠肝细胞系为阴性对照。用Trizol 试剂提取足细胞总RNA, 按照反转录试剂盒的操作步骤反转录合成cDNA, 将产物进行PCR检测, 反应体系参照试剂盒说明书, 反应条件:95 ℃ 3 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 40个循环, 每样品做3个复管。
引物和内参序列如下:Podocin-F, 5'-CACTCTTCAGTCGCTGTCCA-3'; Podocin-R, 5'-AGTTGATGCTCCCTTGTGCT-3'。GAPDH-F 5'-TGGCCTTCCGTGTTCCTAC-3'; GAPDH-R, 5'-GAGTTGCTGTTGAAGTCGCA-3'。
采用SPSS 18.0统计软件进行分析, 计量数据采用
差异过筛法获得肾小球纯度达(90.2± 1.6)%, 1只C57/BL6J小鼠可以得到(10 421± 2421)个肾小球; 视野中肾小球结构完整, 可见肾小管碎片。免疫磁珠法获得的肾小球纯度达(96.7± 1.2)%, 1只C57/BL6J小鼠可以得到(16 112± 2651)个肾小球; 视野中肾小球结构完整, 基本无肾小管。免疫磁珠法获得肾小球纯度和数目均高于差异过筛法, 差异均有统计学意义(P< 0.05)。
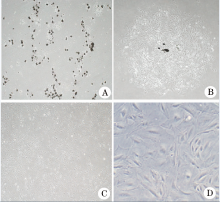
肾小球接种第3天可见80%以上肾小球贴壁, 少量肾小球周围有多边形细胞爬出(图1A), 第7~10天所有贴壁肾小球周围都有大量细胞爬出(图1B)。消化传代后的足细胞继续生长, 为多边形, 无突起伸出, 细胞迅速生长至融合状态, 呈铺路石样外观(图1C)。第14天可呈完全分化状态, 细胞体和细胞核较增殖状态显著增大, 自细胞体伸出明显的树枝样突起, 常见双核, 相邻细胞间形成连接(图1D)。
2.3.1 免疫荧光染色鉴定 原代培养的足细胞均有Podocin蛋白染色, 荧光闪亮, 呈明显的亮绿色, 在细胞浆内以丝状或线性沿细胞骨架分布, 分布均匀, 荧光染色细胞比例均为100%, 证实了培养的细胞确为足细胞(图2)。
2.3.2 PCR法鉴定 原代足细胞和永生化小鼠足细胞均有Podocin基因表达, 而阴性对照组未检测到该基因表达(图3)。
近年来, 慢性肾脏病已经成为全球性的公共卫生问题, 而终末期肾脏病的发病率逐年增高[5]。在导致肾脏损害的病因中, 足细胞作为肾小球滤过屏障的最后一道闸门, 其损伤会导致蛋白尿的发生[6], 进而加重肾脏损害[7]。差异过筛法是最传统的分离肾小球的方法, Krakower等[8]最先报道了分离肾小球的方法, 后来在大鼠[9]和兔[10]上也成功地分离了肾小球, 在此基础上, Burlington等[11]改进了该方法, 减少了金属筛对肾小球的损伤。但总体而言, 差异过筛法的缺点是分离得到的肾小球纯度较低, 往往混有肾小管碎片。
为了提高肾小球的纯度和数量, Takemoto等[12]首次采用免疫磁珠法分离小鼠肾小球, 该方法缺点是费用昂贵。在此基础上, Zhao等[13]改进了实验方法, 利用四氯化三铁代替免疫磁珠行体循环灌注, 极大降低了实验成本, 但是获得的肾小球有限。有别于常规的心脏灌注, Liu等[4]采用胸主动脉灌注, 在肾脏建立局部循环, 较心脏灌注的方法明显提高了免疫磁珠的使用效率。
本研究借鉴并比较了不同的肾小球分离技术, 总结了做好小鼠原代足细胞的培养的一些经验:(1)分离肾小球建议使用免疫磁珠法, 采用胸主动脉灌注, 提高免疫磁珠的使用效率; (2)在消化肾脏皮质的时候, 建议使用胶原酶, 因为胶原酶比较温和, 好掌握消化时间; (3)尽可能地提高肾小球的贴壁率, 包括选择合适的筛网, 动作轻柔, 全程低温操作, 在最短的时间内完成肾小球分离, 使用胶原铺板的培养皿来种植肾小球, 为减少对贴壁的干扰在前3 d避免换液; (4)利用内皮细胞和系膜细胞从肾小球内爬出时间和生长特性不同[14], 在培养10~12 d开始传代。本研究结果提示, 免疫磁珠法较差异过筛法能更高效地分离出高纯度的小鼠肾小球。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|