作者简介:刘 婷,本科学历,主治医师。
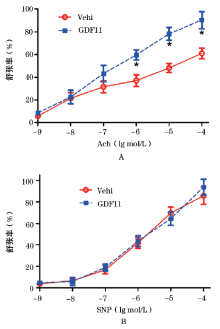
目的 探讨生长分化因子11(growth differentiation factor 11, GDF11)对老龄小鼠内皮依赖性血管舒张功能的影响。方法 选择20只18个月龄C57小鼠随机分为实验组(GDF11组, n=10)和对照组(Vehi组, n=10), GDF11组按0.3 mg/(kg·d)的剂量腹腔注射重组GDF11,Vehi组注射等量生理盐水。4周后取材,检测脂代谢相关的血液学指标,分离小鼠的胸主动脉,测定血管舒张功能和主动脉Samd2/3的磷酸化水平。结果 与Vehi组比较,GDF11干预显著增强乙酰胆碱(Ach)诱导的内皮依赖性血管舒张功能[10-6 mol/L Ach: (37.1±5.2)% vs (59.7±4.3)%;10-5 mol/L Ach: (48.2±4.0)% vs (78.4±5.6)%;10-4 mol/L Ach: (61.1±4.7)% vs (90.2±7.4)%],降低血清中三酰甘油的水平[(76.6±11.2) vs (64.5±10.4) mg/dl],升高脂联素的浓度[(11.9±1.1) vs (14.2±1.7) μg/ml],并能提高主动脉Samd2/3的磷酸化水平[Smad2: (1.00±0.05) vs (1.78±0.10)]、Smad3 [(1.00±0.09) vs (1.57±0.12)]。结论 GDF11对血管内皮细胞有保护作用。
Objective To investigate the effects of GDF11 on endothelium-dependent vasodilation of the aorta in old mice.Methods Twenty 18-month-old C57 mice were randomly divided into GDF11 group [0.3 mg/(kg·d)] recombinant GDF11 intraperitoneal injection, n=10) and Vehi group (equivalent physiological saline injection, n=10). After four weeks of intervention, blood biomarkers of lipid metabolism were tested, while relaxation response and Western blot were determined in the isolated aorta.Results GDF11 intervention significantly increased endothelium-dependent vasodilation in response to acetylcholine (Ach) [10-6 mol/L Ach: (37.1±5.2)% vs (59.7±4.3)%、10-5 mol/L Ach: (48.2±4.0)% vs (78.4±5.6)%、10-4 mol/L Ach: (61.1±4.7)% vs (90.2±7.4)%], decreased triglyceride levels in serum [(76.6±11.2) vs (64.5±10.4) mg/dl], elevated adiponectin protein levels [(11.9±1.1) vs (14.2±1.7) μg/ml] and enhanced protein levels of phosphorylated Samd2/3 [p-Smad2: (1.00±0.05) vs (1.78±0.10)]、p-Smad3 [(1.00±0.09) vs (1.57±0.12)].Conclusions GDF11 can attenuate impaired endothelium-dependent vasodilation in old mice.
动脉硬化是一类以血管管壁增厚变硬、弹性减弱和管腔缩小为特征的疾病, 它严重威胁着人类的健康。该病变从血管内膜起始, 内皮细胞是抵御病变发生的第一道防线, 而内皮依赖性血管舒张功能紊乱则是本病发生的一个早期标志[1, 2]。临床发现, 年龄是该病发生、发展的一个独立危险因素, 近90%的动脉硬化和冠状动脉硬化性心脏病发生在55岁以上的老年人[3]。 GDF 11是一种能抵抗衰老的细胞因子, 属于转化生长因子β (transforming growth factor-β , TGF-β )超家族成员[4]。最近有研究表明, 通过腹腔注射重组GDF 11, 能够促进老龄小鼠脑血管内皮细胞增殖, 进而增加脑血管容积、增大血流量, 从而使脑血管“ 返老还童” [5]。动脉硬化亦属于衰老相关性疾病, 本研究探讨GDF 11对老龄小鼠内皮依赖性血管舒张功能的影响, 以期为临床上治疗动脉硬化提供新靶点。
选择18个月龄雄性SPF级C57BL/6J小鼠20只, 购自军事医学科学院实验动物中心。重组人GDF 11(Pepro Tech, 美国); 去甲肾上腺素(norepinephrine, NE)、乙酰胆碱(acetylcholine, Ach)、硝普钠(sodium nitroprusside, SNP)[Sigma, 美国]; 脂联素(adiponectin)ELISA试剂盒(R& D, 美国); Krebs液自行配制(2.0 L三蒸水中加入氯化钠13.5 g, 氯化钾685.4 mg, 磷酸镁278.4 mg, 磷酸二氢钠278.4 mg, 碳酸氢钠3.7 g, 氯化钙555.0 mg和葡萄糖4.0 g); 一抗[兔抗人单克隆Smad2/3, 磷酸化Smad2/3(p-Smad2/3)抗体]、二抗[山羊抗兔单克隆抗体(辣根过氧化物酶标记)](CST, 美国); BCA测定试剂盒(南京建成, 中国); PVDF膜(Millipore, 美国)。
BL-420S型生物信号采集系统、JH-2型张力换能器与HV-4恒温灌流系统(成都泰盟, 中国); 7600-020型全自动生化分析仪(日本日立公司); 340型酶标仪(BDSL, 英国); DYY-7C型电泳仪、DYCZ-40型转膜仪(北京六一, 中国)。
小鼠于军事医学科学院实验动物中心SPF级环境中饲养, 环境温度(25± 1)℃, 相对湿度(65± 5)%, 光照12 h/d。所有小鼠均单笼饲养, 自由进食、进水。小鼠适应性喂养1周后按随机数字表均分为Vehi组(n=10)和GDF11组(n=10)。GDF11组按0.3 mg/(kg· d)的剂量连续4周腹腔注射GDF11, Vehi组则注射等量生理盐水。
每3 d测量一次所有小鼠的体重。实验结束前12 h开始, 所有小鼠禁食但不禁水。实验结束时, 按60 mg/kg的剂量腹腔注射10 g/L戊巴比妥进行麻醉, 开腹后用棉签将腹腔脏器拨至左侧, BD针于后腔静脉采血后注入黄盖促凝采血管, 待血液凝固后收集血清置于液氮中冻存备用。迅速开胸, 去除肺组织, 在体式显微镜下用显微剪和显微镊剥离胸主动脉血管鞘及其周围的结缔组织。然后齐根端剪断肋间动脉, 剪下胸主动脉并将其均分为两段, 一段冻存于液氮中; 另一段浸泡于Krebs液中备用(4 h内检测)。使用全自动生化分析仪检测血清中三酰甘油(triglycerides, TG)和胆固醇(total cholesterol, TC)的含量。严格按照试剂盒的使用说明, ELISA法检测脂联素的含量。
将每只小鼠的胸主动脉降段剪成2段, 每段长约4 mm。将血管环置于含Krebs液的恒温(37 ℃)灌流系统的浴槽中, 并持续输入95% O2+5% CO2的混合气体。使用两根不锈钢钢丝平行于管壁穿过血管环, 下端钢丝通过挂钩固定于槽底, 上端钢丝通过挂钩连接于张力换能器, 张力换能器与生物信号采集系统相连, 可记录血管环张力的变化。调整基础张力值为0.5 g, 平衡约1 h, 期间每20 min换一次Krebs液。待张力平衡后, 向浴槽内加入10-6 mol/L的NE收缩血管环, 待血管环收缩达平台期时记录最大张力值。排净含有NE的Krebs液, 依次加入不同浓度(10-910-4 mol/L; 每次换液前均以Krebs液灌洗3次血管环)的Ach或者SNP诱导血管环舒张, 并记录每只小鼠各浓度下血管环的张力值(取4个血管环的平均张力)。采用下面的公式计算血管舒张率:血管舒张率(%)=[(最大张力值-各浓度点张力值)/(最大张力值-基础张力值)]× 100%。
取出液氮中冻存的主动脉, 制备组织匀浆并提取总蛋白。测定总蛋白浓度后, 各样本取50 μ g总蛋白, 上样于PAGE胶后电泳。电泳后转膜于PVDF膜上, 室温下封闭2 h, 分别滴加特异性一抗封闭过夜, 再以辣根过氧化物酶标记的二抗封闭2 h, 最后用化学发光剂染色、显影。
采用GraphPad Prism 7.0进行统计学分析并绘图。数据采用
相较于Vehi组, GDF 11干预全程不引起老龄鼠体重的改变, 差异无统计学意义(图1), GDF 11干预显著降低血清中TG的水平[(76.6± 11.2) vs (64.5± 10.4) mg/dl], TC的浓度也呈降低的趋势[(149± 17) vs (124± 20) mg/dl]。同时, GDF 11干预可显著升高血清中脂联素的浓度[(11.9± 1.1) vs (14.2± 1.7) μ g/ml]。
加入不同浓度Ach后, 两组老龄鼠的血管环均出现不同程度的内皮依赖性舒张, 在10-6、10-5、10-4(mol/L)浓度时, GDF 11显著升高内皮依赖性血管舒张率[(37.1± 5.2)% vs (59.7± 4.3)%、(48.2± 4.0)% vs (78.4± 5.6)%、(61.1± 4.7)% vs (90.2± 7.4)% ]; 差异有统计学意义(P< 0.05, 图2A), 而各浓度SNP诱导的非内皮依赖性血管舒张反应, 两组间差异均无统计学意义(图2B)。
本研究以重组GDF 11干预的老龄鼠为动物模型进行实验, 结果发现GDF 11可以增强老龄鼠胸主动脉内皮依赖性血管舒张功能, 但对非内皮依赖性血管舒张功能无影响, 从而证明GDF 11对因增龄而受损的血管内皮细胞具有保护作用。
血管内皮细胞功能紊乱是动脉硬化发生、发展的早期病理改变, 检测内皮依赖性血管舒张功能可以预测该病发生的风险, 早期诊断并评估预后[6]。通过加入Ach可以诱导内皮依赖性血管舒张功能, Ach与血管内皮细胞上的M型胆碱能受体结合, 刺激细胞合成、分泌内皮依赖性血管舒张因子, 这些舒张因子以旁分泌的形式作用于血管壁中膜平滑肌细胞使其松弛。而硝酸甘油和SNP等硝基化合物则可以不依赖于内皮细胞, 直接释放NO等舒血管物质作用于血管平滑肌细胞使其舒张。在本研究中, 两组血管环的非内皮依赖性血管舒张功能无显著性差异, 说明血管平滑肌细胞的功能未因增龄而受损。所以Ach诱导产生的血管舒张反应差异是由于内皮细胞功能不同造成的, 即GDF 11通过改善内皮依赖性血管舒张功能保护因增龄而受损的血管。以往有研究报道发现GDF 11可以改善高脂饮食诱导造成的内皮依赖性血管舒张功能紊乱[7], 这与本研究的结果相似。
动脉硬化病变从血管内膜开始出现脂质堆积, 引起血管壁的炎性反应和氧化应激, 巨噬细胞和T淋巴细胞浸润, 泡沫细胞形成, 细胞外基质降解和平滑肌细胞增生。由此可见脂代谢异常是动脉硬化发生的病变基础。本研究结果也表明, GDF 11能降低血清中TG和TC的浓度, 并且能够显著升高血中脂联素的浓度。脂联素是脂肪细胞分泌的一种内源性的生物活性肽, 已被证实具有抗动脉粥样硬化和炎性反应的作用。以往的研究结果显示, 血管周围脂肪组织分泌的脂联素以旁分泌的形式[8], 机体其他部位脂肪组织分泌的脂联素以内分泌的形式作用于血管内皮细胞, 对其有直接、确切的保护作用[9, 10] 。脂联素与内皮细胞上的脂联素受体结合后通过激活AMPK-eNOS信号途径增加NO的产量, 而血循环中脂联素的浓度在肥胖、2型糖尿病和老年个体中均下降[11]。GDF 11可能是通过延缓因增龄而降低的脂联素浓度或者直接升高血循环中脂联素的含量来间接保护内皮细胞的。以上结果提示, 改善脂代谢可能是GDF 11间接发挥内皮保护作用的机制之一。
TGF-β 超家族广泛参与细胞的增殖、分化和胚胎发育[12]。GDF 11可结合于细胞表面的TGF-β Ⅱ 型受体, 将该受体被激活后, 其激酶活性将TGF-β Ⅰ 型受体磷酸化激活; TGF-β Ⅰ 型受体又使Smad2和Smad3磷酸化; 磷酸化的Smad2和Smad3可与Smad4形成三聚体, 并转移至核内调控基因表达[13]。梅稳等[14]研究发现, GDF 11可以通过激活糖尿病小鼠内皮细胞中的Samd2/3信号通路, 上调eNOS活性, 进而增加NO等舒血管因子的产量来保护血管。本研究的结果也表明, GDF 11干预可以显著提高主动脉Samd2/3的磷酸化水平。这提示激活Samd2/3信号通路可能是GDF 11直接发挥内皮细胞保护作用的信号机制之一。
综上所述, 本研究发现GDF 11能够改善老龄鼠胸主动脉的内皮依赖性血管舒张功能。因此, 升高体内因增龄而下降的GDF11浓度可能是预防和治疗衰老性动脉硬化的一个潜在靶点。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|