作者简介:陈晓伟,本科学历,护师。
目的 观察富氢盐水对大鼠压疮深部骨骼肌氧化应激及炎性反应的干预效果,探讨NLRP3炎性小体在其中的生物效应。方法 30只SD大鼠随机分为对照组(C)、压疮+生理盐水组(PU+S)和压疮+富氢盐水组(PU +HS)。PU+S和PU +HS组大鼠双下肢制备压疮模型。模型建立成功后,PU +HS组大鼠每日腹腔注射富氢盐水(10 ml/kg体重)1次,连续5 d。末次注射后24 h处死大鼠,检测骨骼肌MDA 、IL-1β含量、Caspase-1活性、NLRP3和ASC蛋白表达。结果 PU+HS组与PU+S组比较,MDA 、IL-1β含量和Caspase-1活性均显著降低(分别为14.92±3.11 vs 27.40 ±4.42,1.13±0.25 vs 1.42±0.35和0.69±0.18 vs 1.05±0.19, P<0.05),NLRP3和ASC蛋白表达均显著降低(分别为122.29±19.96 vs 178.49±18.62,105.33±16.67 vs 129.49±18.77, P<0.01)。结论 富氢盐水可能通过抑制氧化应激下调NLRP3炎性反应小体活化水平,进而抑制压疮诱导深部骨骼肌的炎性反应。
Objective To explore the effect of hydrogen-rich saline on the oxidative stress and inflammation in skeletal muscle of pressure ulcer model rats, and to investigate the biological effect of NLRP3 inflammasome.Methods Thirty male Sprague Dawley rats were randomly divided into three groups: control group (C), pressure ulcer + saline group (PU+S), and pressure ulcer + hydrogen-rich saline group (PU +HS). The PU+S and PU +HS rats were loaded with 22.47kPa pressure and kept 2 hours for simulation of ischemia, and simulate reperfusion 30 minutes later. Every rat was performed this treatment 5 cycle everyday, for 3 days. After pressure ulcer model established, PU+HS rats subjected to intraperitoneal injection of hydrogen-rich saline (10 ml/kg) for 5 days. Then MDA level, IL-1β content, Caspase-1 activity, NLRP3 and ASC protein expression were measured.Results As compared with PU+S group, in PU+HS group, MDA level, IL-1β content and Caspase-1 activity were significantly decreased (14.92±3.11 vs 27.40±4.42,1.13±0.25 vs 1.42±0.35 and 0.69±0.18 vs 1.05±0.19, respectively, P<0.050.01). Furthermore, NLRP3 and ASC protein expression were significantly suppressed (122.29±19.96 vs 178.49±18.62 and 105.33±16.67 vs 129.49±18.77, respectively, P<0.01).Conclusion Hydrogen-rich saline could prevent NLRP3 inflammasome activation through suppressing oxidative stress, which in turn inhibit pressure ulcer induced inflammation in skeletal muscle.
压疮(pressure ulcer)是长期卧床患者常见并发症。局部组织长时间挤压导致供血障碍, 挤压解除后供血恢复导致形成再灌注病理改变, 反复的缺血再灌注损伤导致皮肤及骨骼肌细胞凋亡、组织坏死。研究表明, 压疮发生起始于深层骨骼肌, 继而发展至表层皮肤, 骨骼肌缺血再灌注损伤程度决定了压疮的病理进程[1] 。骨骼肌成为治疗压疮的关键靶器官。炎性反应是骨骼肌缺血再灌注损伤的重要病理机制之一[2] 。NLRP3炎性小体(NLRP3 inflammasome)在免疫应答和炎性反应中发挥重要作用, 由NOD样受体、凋亡相关斑点样蛋白(ASC)及天冬氨酸特异性半胱氨酸蛋白酶-1(caspase-1)共同组成。Stojadinovic等[3] 证明, 压疮深部骨骼肌NLRP3炎性小体各组件蛋白表达明显升高。提示NLRP3炎性小体参与了压疮的病理改变。
氧化应激是NLRP3炎性小体的重要活化机制[4] 。氢分子具有很强的还原活性, 可选择性抑制亚硝酸阴离子、羟自由基等活性氧(reactive oxygen species, ROS)成员的活性。研究表明, 富氢盐水可有效抑制心、肺、肝、肾、脑等脏器缺血再灌注损伤[5] 。Huang等[6] 利用止血带制备骨骼肌缺血再灌注模型, 发现再灌注前腹腔注射富氢盐水显著抑制骨骼肌细胞凋亡。本研究拟观察富氢盐水对压疮深部骨骼肌NLRP3炎性小体的干预效果, 以探讨富氢盐水用于压疮治疗的可能性。
健康雄性SD大鼠30只, 购于军事医学科学院动物中心, 体重(209.2± 18.6) g。适应性饲养阶段, 动物自由进食水, 相对湿度45%~65%, 温度(22± 1)℃, 12 h光照。大鼠饲养和干预均符合实验动物伦理学要求。
采用随机数字表法, 大鼠分为3组:对照组(Control group, C)、压疮+生理盐水组(Pressure ulcer + saline group, PU+S)和压疮+富氢盐水组(Pressure ulcer + hydrogen-rich saline group, PU +HS), 每组10只。PU+S和PU+HS组大鼠参照文献[7]方法制备双侧股薄肌压疮模型。压疮模型建立成功后, PU+HS组大鼠每日腹腔注射饱和富氢盐水(氢气浓度0.6 mmol /L, 10 ml/kg体重)一次, 连续5 d。PU+HS组大鼠每日腹腔注射生理盐水(10 ml/kg体重), 连续5 d。对照组正常进食水, 不予任何处理。各组大鼠均于末次腹腔注射后24 h断头处死, 分离双侧股薄肌用于指标检测。
(1)参照试剂盒(南京建成生物工程研究所)说明书操作, 采用硫代巴比妥酸比色法, 于紫外分光光度计测定反应体系吸光度值, 计算骨骼肌组织丙二醛(MDA)含量(nmol/mg pro)。(2)参照大鼠骨骼肌组织IL-1β 定量酶联检测试剂盒(上海碧云天生物技术有限公司)说明书操作, 采用ELISA法, 于荧光酶标仪测定各组骨骼肌组织IL-1β 含量(pg/mg pro)。(3)参照试剂盒(南京建成生物工程研究所)说明书操作, 采用荧光光分光光度法, 于荧光酶标仪测定反应体系荧光强度。C组骨骼肌组织Caspase-1活性定义为1, PU+S和PU+HS组Caspase-1活性为与C组比较的相对活性。
Western blot法检测, 以β -actin为内参。包含10 μ g骨骼肌的组织匀浆与SDS上样缓冲液混合加热处理5 min, 上样后经SDS-PAGE电泳分离, 湿转法转移至PVDF膜, 对应一抗振荡孵育12 h, PBS洗净后用辣根过氧化物酶标记二抗静置孵育1 h, PBS洗净后用显色试剂盒显影, X-ray胶片曝光记录。扫描条带灰度值, C组条带灰度值定义为100%, PU+S和PU+HS组为与C组比较的相对表达量。
计量资料以
与C组比较, PU+S组MDA 、IL-1β 含量和Caspase-1活性均显著升高(P< 0.01), PU+HS组IL-1β 含量显著升高(P< 0.05)。PU+HS组与PU+S组比较, Caspase-1活性、MDA和IL-1β 含量显著降低(P< 0.01, 表1)。
| 表1 实验鼠各组骨骼肌MDA 、IL-1β 含量和Caspase-1活性的变化(n=10; |
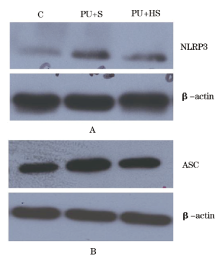
与C组比较, PU+S组NLRP3蛋白表达显著升高(178.49± 18.62 vs 100.00± 10.07, P< 0.01), PU+HS组NLRP3蛋白表达升高(122.29± 19.96 vs 100.00± 10.07, P< 0.05)。PU+HS组NLRP3蛋白表达低于PU+S组(P< 0.01)(图1A)。与C组比较, PU+S组ASC蛋白表达显著升高(129.47± 18.62 vs 100.00± 12.92, P< 0.01), PU+HS组ASC蛋白表达无统计学差异(105.33± 16.67 vs 100.00± 12.92, P< 0.05)。PU+HS组ASC蛋白表达低于PU+S组(P< 0.01)(图1B)。
氧化应激与诸多疾病发生密切相关, 富氢盐水因其抗氧化特质受到研究者的关注。研究表明, 大鼠腹腔注射富氢盐水1 h后, 血浆氢分子浓度可达到μ M水平, MDA含量显著下降, 是一种有效的氢分子抗氧化给药模式[8] 。本研究中, 连续腹腔注射富氢盐水5 d可显著降低压疮深层股薄肌MDA含量。氧化应激水平受到ROS产生和抗氧化酶活性的共同影响, MDA是生物膜脂类过氧化最主要的产物, 可反映机体氧化应激水平。研究表明, 氢可选择性与强氧化性ROS直接发生还原反应[5] 。此外, Meng等[9] 研究证明, 富氢盐水可激活转录因子Nrf2, 后者可促进SOD、HO-1等一系列内源性抗氧化酶表达。以上提示, 富氢盐水可有效抑制压疮导致的骨骼肌氧化应激。
IL-1β 是炎性反应中重要的促炎细胞因子之一, 以无活性前体形式合成并存在, 在IL-1β 转化酶催化水解反应后转化为具有促炎效应的成熟IL-1β 。免疫组化结果显示, 压疮表层皮肤及深层肌肉组织IL-1β 高表达[1] 。研究表明, IL-1β 可通过刺激巨噬细胞过度释放细胞因子参与缺血对骨骼肌的损伤[10] 。此外, IL-1β 可激活泛素-蛋白酶体通路导致缺血状态下骨骼肌蛋白降解[11] 。本研究表明, 富氢盐水显著降低压疮深层股薄肌IL-1β 含量。Okamoto等[12] 在肠梗阻大鼠模型中也发现, 连续腹腔注射富氢盐水10 d显著降低肠壁肌层IL-1β 表达水平。以上提示, 富氢盐水可有效抑制压疮深部组织炎性反应。
氧化应激与IL-1β 产生密切相关, 目前被证明的有两条通路:一是ROS激活转录因子NFκ B, 后者结合IL-1β 启动子, 促进其表达; 二是ROS激活NLRP3炎性反应小体中识别蛋白NOD样受体, 使之聚集形成NLRP3寡聚体, 通过衔接蛋白ASC募集并激活效应蛋白caspase-1, 后者活化后切割白介素1-β (IL-1β ), 使之形成成熟炎性反应因子[13] 。本研究表明, 富氢盐水显著抑制了压疮深部骨骼肌NLRP3炎性小体活化, 表现为NLRP3和ASC蛋白表达降低, 同时caspase-1活性下降。研究表明, NLRP3炎性小体抑制剂INF4E明显抑制缺血再灌注导致的心肌线粒体损伤, 部分恢复心脏收缩功能[14] 。Ystgaard等[15]报道, 与野生型鼠比较, NLRP3敲除鼠海马组织对缺血的抵抗力更强。以上提示, 抑制NLRP3炎性反应小体活性是富氢盐水改善压疮的靶向之一。
总之, 富氢盐水可能通过抑制氧化应激下调NLRP3炎性反应小体活化水平, 进而抑制压疮诱导深部骨骼肌的炎性反应, 是一种潜在的改善压疮的治疗方式。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|