作者简介:邓邦莲,硕士研究生,副主任医师。
目的 探究不同粒径的石墨烯量子点(graphene quantum dots,GQDs)在PC12细胞中的细胞成像效应及细胞毒性。方法 通过动态光散射法(DLS)对GQDs的水合粒径和zeta电位进行表征,采用CCK-8试剂盒检测GQDs对PC12细胞的毒理效应,使用激光共聚焦显微镜比较不同粒径的GQDs在PC12细胞中的荧光成像效应。结果 GQDs对PC12细胞的毒性效应是呈尺寸依赖性的,15 nm的GQDs比50 nm GQDs对PC12细胞的细胞毒性低,500 μg/ml的15 nm GQDs孵育48 h后,细胞活力仍保持在80%以上。对15 nm的GQDs更容易被PC12细胞摄取,80%以上的细胞能成功显影,表现优异的细胞成像效应。结论 GQDs细胞毒性低,细胞成像效果好,是一种适合神经系统成像的纳米材料。
Objective To evaluate the biological imaging effect and biocompatibility of graphene quantum dots (GQDs) of different size in PC12 cells.Methods The hydrodynamic size and zeta potencial of GQDs in distilled water (DW) were determined by dynamic light scattering (DLS). Furthermore, cell survival rates following treatment with GQDs were evaluated using the CCK-8 assay and the biological imaging effect of GQDs in PC12 cells was observed under a confocal microscope.Results The toxic effect of GQDs in PC12 cells was size-dependent. The results of CCK-8 assay indicated that 15 nm GQDs showed lower toxicity than CDs in PC12 cells. After PC12 cells were incubated 48 h with 500 μg/ml GQDs, cell viability remained at 80% or more. What’s more, 15 nm GQDs could be taken up by PC12 cells more easily and more than 80% cells could be labeled successfully, which indicated good biological imaging effects.Conclusions GQDs have low cytotoxicity and excellent biological imaging properties, which are a suitable nanomaterial for neuroimaging.
随着纳米技术的高速发展, 越来越多的纳米材料应用于生物成像和生物载药等生命科学领域。碳量子点(carbon dots, CDs)是一种新型的荧光纳米材料, 以碳原子为基本结构单元, 根据化学结构的不同分为球状结构的碳纳米点(carbon nanodots, CNDs), 具有单层或多层片状结构的石墨烯量子点(graphene quantum dots, GQDs), 或聚集颗粒状的聚合物点(polymer dots, PDs)[1]。其中, GQDs不仅具备了CNDs的优点, 如:发光性能好、水溶性佳、毒性低、生物相容性优异, 同时兼具了石墨烯材料的特性, 如高比表面积、表面官能团丰富等[2, 3]。由于GQDs独特的性能, 现已被广泛应用于生物成像、传感、生物载药等多个技术领域[4, 5, 6]。
目前研究主要集中于新的合成方法以提高GQDs的产率、表面修饰与改性、肿瘤细胞成像等方面, 对于其在神经示踪及生物毒性的研究较少。GQDs对神经细胞的成像效果如何, 目前研究尚浅。本研究拟通过构造GQDs与PC12细胞共培养的模型, 探究不同粒径的GQDs在PC12细胞中的细胞成像效应及细胞毒性。
主要材料:15 nm与50 nm GQDs由南京先丰纳米材料科技有限公司提供。PC12细胞系购自中国科学院上海细胞库。主要试剂:澳洲胎牛血清(FBS)、DMEM培养液、PBS缓冲液(Gibco, 美国); 0.25%胰蛋白酶(含EDTA)(Sigma-Aldrich, 美国); CCK-8细胞增殖毒性检测试剂盒(Dojindo, 日本); 多聚甲醛 (广州塞拉芬生物科技有限公司)
二氧化碳培养箱、生物安全柜(ESCO, 新加坡); 医用冷藏冰箱(青岛海尔特种电器有限公司); 超低温冰箱(KALTIS, 美国); 超声波清洗机(宁波新芝生物科技股份有限公司); 三用恒温水箱(金坛市杰瑞尔电器有限公司); 微量加样器(1-1000 μ L)(eppendorf, 德国); M5多功能酶标仪(MDS, 美国); 马尔文动态光散射仪(Malvern Instruments, 英国); 激光共聚焦显微镜(Olympus, 日本)。
1.3.1 GQDs的表征 采用动态光散射法(DLS)对GQDs的水合粒径和zeta电位进行测定, 测定条件为25 ℃, 散射角173° , 折射率1.33, 激光波长633 nm。
1.3.2 PC12细胞的传代与培养 实验前进行超净台、实验器材消毒和实验试剂预热等准备工作。配置含10% FBS、1%双抗的完全培养液用于培养细胞, 将其置于37 ℃、5% CO2恒温细胞培养箱中培养。定期观察细胞的生长状态及培养液的颜色, 光镜下健康的PC12细胞贴在培养平底, 呈长梭形, 培养液清亮无杂质。平均2 d进行细胞换液, 当细胞生长面积占培养瓶面积80%左右时, 进行细胞传代。将旧培养液弃掉, 加入预热的PBS缓冲液润洗细胞1~2次, 弃掉PBS缓冲液后, 加入0.25%胰蛋白酶进行细胞消化5 min, 直至显微镜下观察细胞变圆将要分离, 加入完全培养液终止消化。使用移液器将培养瓶底的细胞吹打脱落, 吹打均匀后, 将细胞悬液置于15 ml离心管中, 1000 r/min, 离心5 min, 弃上清, 向离心管中加入完全培养液, 重悬细胞。根据实验所需, 将细胞按照1∶ 3或1∶ 4稀释至新的培养瓶中, 置于37 ℃ 、5% CO2恒温细胞培养箱中继续培养。
1.3.3 不同粒径GQDs对PC12细胞系的增殖-毒性检测 (1)实验分组:空白对照组, 不含细胞和实验材料的培养液; 阴性对照组, 含有细胞和培养液, 不含实验材料; 实验组, 含有细胞、培养液和不同浓度的GQDs悬浮液, 设置8个剂量浓度, 分别是20、40、80、120、160、200、250、500 μ g/ml。2个时间点:24 h、48 h。每组设置6个复孔。(2)CCK-8法测定细胞毒性步骤:收集处于对数生长期的PC12细胞, 制成细胞悬液, 将按照5× 103每孔的密度加入96孔培养板中, 每孔100 μ l, 将96孔培养板置于37 ℃二氧化碳培养箱恒温培养24 h。观察细胞贴壁及生长情况, 弃去96孔板中原培养液, 按照实验设计加入不同浓度含GQDs的细胞培养液, 将96孔板放入培养箱中孵育24、48 h。在各检测时间点移除 96 孔板内的原有培养液, 每孔加入预先配置的CCK-8检测液100 μ l, 继续培养30 ~60 min, 在多功能酶标仪OD 450 nm处测量各孔的吸光度值。计算细胞相对存活率, 计算公式如下:细胞相对存活率(Survive rate)=[(As-Ab)/(Ac-Ab)]× 100%, 其中As为实验孔OD值, Ac为对照孔OD值, Ab为空白孔OD值。
1.3.4 不同粒径GQDs对PC12细胞系的荧光成像检测 收集处于对数生长期的PC12细胞, 制成细胞悬液, 将按照5× 104每孔的密度加入共聚焦皿中, 每孔2 ml, 将共聚焦皿置于37 ℃二氧化碳培养箱恒温培养24 h。观察细胞贴壁及生长情况, 弃去皿中原培养液, 加入含250 μ g/ml GQDs的细胞培养液, 将共聚焦皿放入培养箱中孵育1 h。弃去共聚焦皿内原有培养液, PBS润洗2~3次。加入4%多聚甲醛固定20 min, PBS润洗3次, 共聚焦显微镜下观察荧光成像效果。
采用 SPSS 22.0软件数据进行统计学分析。实验数据以
原始粒径15 nm的GQDs在去离子水中的水合粒径为(100.2± 13.7)nm, zeta电位为+13.6 mV; 原始粒径50 nm的GQDs在去离子水中的水合粒径为(187.6± 17.5)nm, zeta电位为+11.4 mV; 原始粒径15 nm的GQDs在去离子水中的水合粒径小于50 nm的, 差异有统计学意义(P< 0.05)。
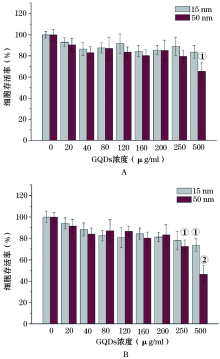
CCK-8检测结果表明, 在24 h时间点, 15 nm的GQDs对PC12细胞基本无毒性作用, 各浓度干预后, 细胞活力均保持在80%以上, 而500 μ g/ml的50 nm GQDs明显降低了PC12细胞活力(P< 0.05)。当干预时间达48 h时, 浓度小于200 μ g/ml的GQDS对PC12细胞活力基本无影响, 随着GQDs作用浓度的增高, 500 μ g/ml的15 nmGQDs使细胞活力降至80%以下。50 nm的GQDS对PC12细胞表现出更明显的细胞毒性, 浓度高于250 μ g/ml后, 细胞活力明显下降(图1)。
材料的理化性质是影响其与细胞相互作用的关键因素。GQDs的表征结果表明, GQDs带正电荷, 且15 nm粒径的GQDs表面电荷大于50 nm粒径的GQDs。由于本研究采用GQDs混悬液的方式与PC12细胞相互作用, 故GQDs在水溶液中的粒径分布十分重要, 50 nm的GQDs的水合粒径明显大于15 nm的GQDs的水合粒径。本研究结果表明, GQDs在溶液中有一定程度的聚合, 聚合作用会影响材料与细胞的相互作用[7], 因此, 处理细胞前应对材料进行分散, 降低聚合作用对实验结果的影响。
随着GQDs在生命医学领域的应用日益广泛, 同时人们开始担心其对机体的毒害作用。虽然目前大部分研究认为, GQDs对机体的毒性作用较低, 但仍有部分学者对此持有否定的观点。Markovic等[8]报道, GQDs能诱导人神经胶质瘤U251细胞产生活性氧ROS, 引起氧化应激反应, 而且进一步导致细胞自噬反应及凋亡的发生。另一项研究指出, GQDs的长期暴露能导致秀丽隐杆线虫运动频率的下降、头部和咽部的异常动作, 反映了GQDs对多巴胺和谷氨酸神经元的慢性毒性[9]。CCK-8检测结果反应, 15 nm的GQDs对PC12细胞无明显毒性, 50 nm的GQDs的细胞毒性也较低, 然而随着干预浓度的增加和干预时间的延长, 仍然展现出一定的毒害作用。本研究的结果与文献[10, 11]报道的结果一致, GQDs的毒性较低, 是一种生物安全性较好的纳米材料, 未来需要更完善的体内与体外研究来进一步确定GQDs的生物安全性。
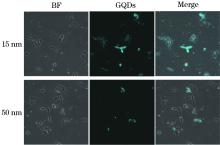
GQDs由于其优秀的发光性能, 良好的生物相容性, 被应用于生物成像方面。激光共聚焦显微镜结果表明, 15 nm和50 nm的GQDs都能被PC12细胞摄取, 且发出明亮的荧光, 成功显影PC12细胞, 但是15 nm的GQDs表现出更优秀的细胞成像效应。Eda等[12]研究发现, GQDs的光学性能是尺寸依赖性的, 粒径越小的GQDs光致发光强度越高。此外, GQDs的细胞成像效应也与细胞对其的摄取率相关。研究发现, 细胞对纳米颗粒的摄取与其粒径、形状、比表面积、表面电荷和表面修饰等因素相关[13, 14]。尺寸越小的纳米颗粒更容易被细胞摄取[15]。此外, 纳米颗粒的表面电荷是影响细胞对其摄取的另一个重要因素[16], 研究发现, 由于细胞膜表面带有负电荷, 相比起阴性电位的纳米颗粒, 阳性电位的纳米颗粒更容易被吸附到细胞表面, 甚至进入细胞内[17]。15 nm的GQDs表面带的正电荷比50 nm的电荷高, 因此更容易被细胞摄取。本实验的结果表明, PC12细胞对GQDs的摄取是呈尺寸依赖性的, 尺寸小的GQDs生物毒性低, 更容易被细胞摄取, 细胞成像效应更好, 更适合用于神经系统生物成像。
综上, 本实验探究了不同粒径的GQDs在PC12细胞中的毒性与荧光成像效应, 结果证实, 小粒径的GQDs对PC12细胞的细胞毒性更低, 更容易被细胞摄取, 细胞成像效果更好。GQDs是一种合适的神经示踪材料, 其在神经系统的应用与毒理研究需更进一步的探究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|